UV-vis absorptie: definitie en werking van UV-vis spectroscopie
Leer hoe UV‑vis absorptie moleculen exciteert en inzicht geeft in structuur en concentratie — overzicht van principes, werking en toepassingen van UV‑vis spectroscopie.
UV-zichtbare absorptie is het proces waarbij een molecuul ultraviolet of zichtbaar licht opneemt zodat elektronen naar een hogere energietoestand worden gebracht. Die opname verhoogt de energie van het systeem en veroorzaakt een overgang van de grondtoestand naar één of meer aangeslagen toestanden. Dit fenomeen vormt de basis van de analytische techniek absorptiespectroscopie, meer specifiek van wat men UV‑vis spectroscopie noemt.
Basisprincipes
In UV‑vis spectroscopie wordt licht door een oplossing of vaste stof gestuurd en wordt gemeten welke golflengten worden geabsorbeerd. Een absorptiespectrum toont de absorptie (of optische dichtheid) als functie van golflengte. Typische grootheden zijn:
- λmax — de golflengte waarop de absorptie maximaal is.
- ε (molaire extinctiecoëfficiënt) — maat voor hoe sterk een stof licht absorbeert bij een bepaalde golflengte.
- A — de geobserveerde absorptie (optische dichtheid).
Elektronische overgangen
Verschillende typen elektronische overgangen veroorzaken absorptie in verschillende delen van het spectrum:
- π → π* : komen typisch voor bij geconjugeerde dubbele bindingen en geven vaak sterke absorptie in het UV/vis-gebied.
- n → π* : optreden bij niet‑gebonden elektronen (zoals bij carbonylgroepen); deze overgangen zijn vaak zwakker en kunnen naar langere golflengten verschuiven.
- σ → σ* : vereisen meestal veel energie en treden op in de diepe UV.
De aanwezigheid van conjugatie, ringstructuren en elektronische substituenten beïnvloedt zowel de positie van λmax als de intensiteit (ε).
Instrumentatie en werking
Een UV‑vis-spectrometer bestaat grofweg uit:
- Een lichtbron (bijv. deuteriumlamp voor UV en halogeenlamp voor zichtbaar).
- Een monochromator of een grating om specifieke golflengten te selecteren (of een polychromator in een fotodiode-array detector).
- Een cuvet of monsterkamer (voor UV vaak kwarts cuvetten gebruiken omdat glas UV absorbeert).
- Een detector (bijv. fotomultiplicator of fotodiode-array) die de intensiteit meet.
Spectrumopnames kunnen in één punt (fixed‑wavelength), als scans over een bereik, of in realtime met snelle detectors uitgevoerd worden.
Kwantificering: de Wet van Beer‑Lambert
Voor kwantitatieve analyse gebruikt men de Wet van Beer‑Lambert:
A = ε · l · c
- A = absorptie (adimensioneel)
- ε = molaire extinctiecoëfficiënt (L·mol⁻¹·cm⁻¹)
- l = padlengte van de cuvet (cm)
- c = concentratie van de absorberende soort (mol·L⁻¹)
De wet geldt onder ideale omstandigheden (niet te hoge concentraties, geen verstoring door nevenreacties of turbiditeit). Kalibratielijnen met standaarden verbeteren de nauwkeurigheid.
Monstervoorbereiding en praktische tips
- Kies een oplosmiddel dat zelf niet absorbeert bij de te meten golflengte (bijv. acetonitril of methanol voor veel organische verbindingen; voor diepe UV: kwarts en geschikte oplosmiddelen).
- Gebruik geschikte cuvetten: kwarts voor UV, optisch glas of kunststof voor zichtbaar als de golflengtes dat toelaten.
- Werk binnen het lineaire bereik van de Beer‑Lambert wet: vaak A tussen ~0,1 en 1,0. Verdun monsters die te sterk absorberen.
- Controleer en corrigeer voor achtergrondabsorptie (blanco met oplosmiddel) en baseline‑drift.
Toepassingen
UV‑vis spectroscopie is breed inzetbaar:
- Kwantiatieve analyse — bepaling van concentraties van chromofore stoffen in oplossing.
- Kwalitatieve identificatie — vergelijken van λmax en bandprofielen voor structurele informatie.
- Kinetiek — volgen van reacties in de tijd door verandering in absorptie bij specifieke golflengten.
- Zuiverheidscontrole — detectie van onzuiverheden of degradeerproducten.
- Milieu- en farmaceutische analyses — bepaling van verontreinigingen en formuleringen.
Beperkingen
UV‑vis spectroscopie is niet altijd selectief: verschillende stoffen kunnen op vergelijkbare golflengten absorberen. Bovendien geeft de techniek vooral informatie over elektronische structuur, maar weinig directe detail over exacte molecuulstructuur (waarvoor IR, NMR of MS nuttig zijn). Blumige of deeltjeshoudende monsters kunnen verstoringen veroorzaken doordat ze licht verstrooien in plaats van absorberen.
Samenvattend: UV‑vis absorptie is een eenvoudige, snelle en veelgebruikte techniek om elektronische overgangen in moleculen te bestuderen en concentraties te bepalen. Goede monster‑ en oplosmiddelselectie, juiste instrumentinstellingen en begrip van de onderliggende overgangen verhogen de betrouwbaarheid van de resultaten.
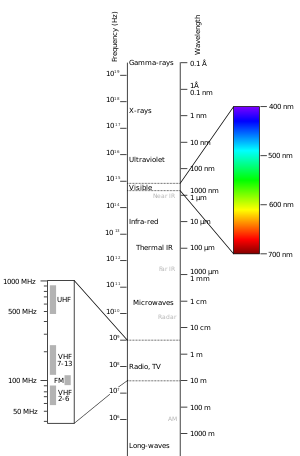
Het elektromagnetisch spectrum
Energieabsorptie
Verschillende moleculen absorberen verschillende golflengten van licht. De golflengten van licht voor UV-zichtbare absorptie gaan van ongeveer 200 nanometer tot 800 nanometer. Dit is een deel van het elektromagnetische spectrum dat is afgebeeld.
Absorptie van licht begint met de blootstelling van energie van een bepaalde golflengte in dit UV-zichtbare gebied aan een molecuul. Het licht/de energie wekt dan de grondtoestand (niet aangeslagen) buitenste of valentie-elektronen op tot een aangeslagen toestand (hoge energie). Het resultaat hiervan kan worden gemeten met een UV-zichtbare spectrofotometer. De gegevens worden weergegeven als een spectrum met absorptie versus golflengte. Dit patroon kan worden gebruikt om eigenschappen van het molecuul te leren kennen. Alleen bepaalde moleculen kunnen licht in dit gebied absorberen.
Chromoforen
Moleculen die licht absorberen bij deze golflengten worden chromoforen genoemd. Chromoforen zijn functionele groepen van een molecuul die licht absorberen in dit UV-Visible gebied. Zij worden meestal gekenmerkt door gedelokaliseerde pi-elektronen. Pi-elektronen verwijzen naar een type binding tussen elektronenbanen die pi orbitalen worden genoemd. Als er veel van deze pi-elektronen in een molecuul aanwezig zijn, kunnen de elektronen worden gedelokaliseerd of verspreid over het molecuul. Een voorbeeld van een dergelijk molecuul is hieronder afgebeeld. Veel kleurstoffen (gekleurde moleculen) worden gekenmerkt door deze gedelokaliseerde pi-elektronen en hun kleur. Deze moleculen kunnen worden gebruikt als pH-indicatoren om te bepalen of een oplossing zuur of basisch is. Toevoeging van zuur of base verstoort de gedelokaliseerde pi-elektronen. Deze verstoring veroorzaakt een kleurverandering.

Lakmoespoeder
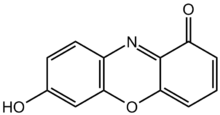
Chemische structuur van 7-hydroxyfenoxazon, de chromofoor van lakmoescomponenten
Wet van Beer
De absorptie van een molecuul kan worden gebruikt om de concentratie van het molecuul in de oplossing te bepalen. Om de concentratie te bepalen wordt de wet van Beer gebruikt. Dit is een wiskundig verband dat wordt weergegeven door onderstaande vergelijking.
A = a b c {Displaystyle A=abc}
A= absorptie, a=absorptiecoëfficiënt, b=padlengte, c=concentratie
De componenten van de Wet van Beer kunnen door proeven worden bepaald. Zij kunnen ook worden gevonden in de literatuur. Als de absorptie wordt gemeten met een UV-zichtbare spectrofotometer (instrument om de absorptie en de golflengte van moleculen te meten), is de weglengte (b) gerelateerd aan het monsterpotje dat bij de proef wordt gebruikt. De monsterhouder (cuvette genoemd) is gemaakt van een materiaal dat in dit gebied geen licht absorbeert. De dikte van deze cuvet is een bekende waarde. Dit is de weglengte die het licht aflegt om het monster te bereiken. De molaire absorptiecoëfficiënt kan worden berekend door de absorptie te meten van een monster met een bekende concentratie en een bekende weglengte. De eenheden van de absorptiecoëfficiënt zijn afhankelijk van de padlengte en de concentratie-eenheden. Molaire absorptie-eenheden zijn L mol-1 cm-1 wanneer de concentratie-eenheden molariteit zijn. De absorptiviteit is een maat voor hoe sterk een molecuul licht bij een bepaalde golflengte absorbeert. Zodra deze constante is bepaald, kunnen uit deze relatie onbekende concentraties worden bepaald.

Beckman DU640 UV/Vis-spectrofotometer.
Zoek in de encyclopedie
