Molecuul
Een molecuul is de kleinste hoeveelheid van een chemische stof die kan bestaan. Als een molecuul in kleinere stukken zou worden gesplitst, zou het een andere stof zijn.
Moleculen bestaan uit atomen die in een bepaalde vorm aan elkaar zijn geplakt. Niet alle combinaties van atomen zijn even goed mogelijk; atomen maken bepaalde vormen bij voorkeur boven andere. Ook hebben ze een andere valentie. Zo hebben zuurstofatomen altijd twee bindingen met andere atomen, koolstofatomen hebben altijd vier bindingen met andere atomen en stikstofatomen hebben altijd drie bindingen met andere atomen.
In de kinetische theorie van gassen wordt de term molecuul vaak gebruikt voor elk gasvormig deeltje, ongeacht de samenstelling ervan. Volgens deze definitie worden edelgasatomen beschouwd als moleculen, omdat het in feite monoatomaire moleculen zijn.
In gassen zoals lucht vliegen de moleculen gewoon rond. In vloeistoffen zoals water zitten de moleculen aan elkaar vast, maar ze kunnen nog steeds bewegen. In vaste stoffen zoals suiker kunnen de moleculen alleen maar vibreren. In de vierde toestand van materie die bekend staat als plasma, zijn de atomen geïoniseerd en kunnen ze geen moleculen vormen.
Met een moleculaire formule kun je de aantallen van alle atomen in een molecuul opschrijven. De moleculaire formule van glucose is bijvoorbeeld C6H12O6. Dat betekent dat één molecuul glucose bestaat uit zes koolstofatomen, twaalf waterstofatomen en zes zuurstofatomen.
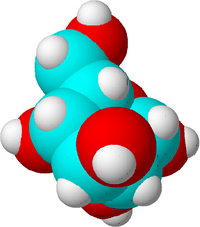
Dit is een suikermolecuul. Koolstofatomen worden blauw gemaakt, zuurstofatomen worden rood gemaakt en waterstofatomen worden wit gemaakt om het verschil te laten zien. In werkelijkheid hebben atomen geen kleur.
Bonding
Om een molecuul te laten bestaan, moeten atomen aan elkaar kleven. Dit gebeurt wanneer twee atomen elektronen delen. In plaats van slechts één atoom te omcirkelen, cirkelt het elektron nu rond twee. Dit wordt een covalente binding genoemd. Soms wordt meer dan één elektron gedeeld. Hoe meer elektronen er gedeeld worden, hoe sterker de binding wordt en hoe sterker de atomen aan elkaar kleven.
Obligaties kunnen ook uit elkaar worden gehaald. Aangezien de meeste obligaties energie nodig hebben om zich te vormen, geven ze ook energie af wanneer ze worden verbroken. Maar voordat de meeste bindingen breken, moet het molecuul worden verhit. Dan beginnen de atomen te bewegen, en als ze te veel bewegen, breekt de binding. Moleculen die minder energie nodig hebben om te breken dan ze afgeven als ze gebroken worden brandstoffen genoemd. Bijvoorbeeld, een kaars zal daar gewoon zitten en er gebeurt niets. Maar als je een lucifer gebruikt om hem aan te steken, zal hij lang branden. De lucifer brengt de energie om de eerste bindingen te breken, die genoeg energie vrijmaken om de bindingen eronder te breken, totdat de kaars is afgebrand.
Er zijn ook ionische banden.
Vragen en antwoorden
V: Wat is een molecuul?
A: Een molecuul is de kleinst mogelijke hoeveelheid van een chemische stof. Het bestaat uit atomen die in een bepaalde vorm aan elkaar vastzitten.
V: Hoeveel bindingen hebben zuurstof-, koolstof- en stikstofatomen?
Antwoord: Zuurstofatomen hebben altijd twee bindingen met andere atomen, koolstofatomen hebben altijd vier bindingen met andere atomen, en stikstofatomen hebben altijd drie bindingen met andere atomen.
V: Wat zegt de kinetische theorie van gassen over moleculen?
Antwoord: Volgens de kinetische theorie van gassen wordt de term molecuul vaak gebruikt voor alle gasvormige deeltjes, ongeacht hun samenstelling. Dit betekent dat edelgasatomen worden beschouwd als moleculen, omdat het eigenlijk mono-atomaire moleculen zijn.
V: Hoe gedragen moleculen zich in verschillende toestanden?
Antwoord: In gassen zoals lucht vliegen de moleculen gewoon rond. In vloeistoffen zoals water zitten de moleculen aan elkaar vast, maar ze kunnen nog steeds bewegen. In vaste stoffen zoals suiker kunnen moleculen alleen trillen. In plasma (de vierde toestand van de materie) zijn atomen geïoniseerd en kunnen ze geen moleculen vormen.
V: Wat is de molecuulformule?
A: De molecuulformule wordt gebruikt om de nummers van alle atomen in een molecuul op te schrijven. C6H12O6 betekent bijvoorbeeld één molecuul glucose, dat bestaat uit zes koolstofatomen, twaalf waterstofatomen en zes zuurstofatomen.
Zoek in de encyclopedie