Elektron | subatomair deeltje
Een elektron is een heel klein stukje materie. Het symbool ervan is e− , het werd ontdekt door J. J. Thomson in 1897.
Het elektron is een subatomair deeltje. Elk atoom bestaat uit een aantal elektronen die de kern van het atoom omgeven. Een elektron kan ook los staan van elk atoom. Het wordt beschouwd als een elementair deeltje omdat het niet kan worden opgesplitst in iets kleiners. Zijn elektrische lading is negatief. Elektronen hebben zeer weinig massa (weinig gewicht), zodat er zeer weinig energie nodig is om ze snel te verplaatsen. Zij kunnen zich bijna met de snelheid van het licht verplaatsen, bijvoorbeeld als bètadeeltjes, en in de binnenste elektronenschillen van elementen met een groot atoomnummer.
Elektronen nemen deel aan gravitationele, elektromagnetische en zwakke interacties. De elektromagnetische kracht is het sterkst in gewone situaties. Elektronen stoten elkaar af (duwen elkaar uit elkaar) omdat ze dezelfde elektrische lading hebben. Elektronen worden aangetrokken door protonen omdat zij een tegengestelde elektrische lading hebben. Een elektron heeft een elektrisch veld, dat deze krachten beschrijft. De elektriciteit die televisies, motoren, mobiele telefoons en vele andere dingen aandrijft, bestaat eigenlijk uit vele elektronen die door draden of andere geleiders bewegen.
Beschrijving
Elektronen hebben de kleinste elektrische lading. Deze elektrische lading is gelijk aan de lading van een proton, maar heeft het tegenovergestelde teken. Daarom worden elektronen aangetrokken tot de protonen in atoomkernen. Door deze aantrekkingskracht vormen elektronen in de buurt van een kern een atoom. Een elektron heeft een massa van ongeveer 1/1836 keer een proton.
Eén manier om na te denken over de plaats van elektronen in een atoom is zich voor te stellen dat zij op vaste afstanden van de kern ronddraaien. Zo bestaan de elektronen in een atoom in een aantal elektronenschillen rondom de centrale kern. Elke elektronenschil krijgt een nummer 1, 2, 3, enzovoort, te beginnen met de schil die het dichtst bij de kern ligt (de binnenste schil). Elke schil kan een bepaald maximum aantal elektronen bevatten. De verdeling van elektronen in de verschillende schillen wordt elektronische rangschikking (of elektronische vorm) genoemd. De elektronische rangschikking kan worden weergegeven door middel van nummering of een elektronendiagram. (Een andere manier om na te denken over de plaats van elektronen is door de kwantummechanica te gebruiken om hun atoombanen te berekenen).
Het elektron is een van de subatomaire deeltjes die leptonen worden genoemd. Het elektron heeft een negatieve elektrische lading. Het elektron heeft nog een andere eigenschap, spin genaamd. Zijn spinwaarde is 1/2, waardoor het een fermion is.
Hoewel de meeste elektronen zich in atomen bevinden, bewegen andere onafhankelijk van elkaar in materie, of samen als kathodestralen in een vacuüm. In sommige supergeleiders bewegen elektronen in paren. Wanneer elektronen stromen, wordt deze stroom elektriciteit genoemd, of een elektrische stroom.
Een voorwerp kan worden omschreven als "negatief geladen" als er meer elektronen dan protonen in een voorwerp zijn, of "positief geladen" als er meer protonen dan elektronen zijn. Elektronen kunnen zich bij aanraking verplaatsen van het ene voorwerp naar het andere. Ze kunnen worden aangetrokken door een ander voorwerp met tegengestelde lading, of worden afgestoten wanneer ze allebei dezelfde lading hebben. Wanneer een voorwerp "geaard" is, gaan de elektronen van het geladen voorwerp de grond in, waardoor het voorwerp neutraal wordt. Dit is wat bliksemafleiders doen.
Chemische reacties
Elektronen in hun schillen rond een atoom vormen de basis van chemische reacties. Volledige buitenste schillen, met maximale elektronen, zijn minder reactief. Buitenschillen met minder dan maximale elektronen zijn reactief. Het aantal elektronen in atomen is de onderliggende basis van het chemisch periodiek systeem.
Meting
Elektrische lading kan rechtstreeks worden gemeten met een elektrometer. Elektrische stroom kan rechtstreeks worden gemeten met een galvanometer. De meting van een galvanometer verschilt van de meting van een elektrometer. Tegenwoordig kunnen laboratoriuminstrumenten individuele elektronen bevatten en observeren.
Een elektron "zien
Onder laboratoriumomstandigheden kunnen de interacties van individuele elektronen worden waargenomen met behulp van deeltjesdetectoren, waarmee specifieke eigenschappen zoals energie, spin en lading kunnen worden gemeten. In één geval werd een Penning-val gebruikt om een enkel elektron gedurende 10 maanden vast te houden. Het magnetisch moment van het elektron werd gemeten met een precisie van elf cijfers, wat in 1980 een grotere nauwkeurigheid was dan voor enige andere fysische constante.
De eerste videobeelden van de energieverdeling van een elektron werden in februari 2008 vastgelegd door een team van de Universiteit van Lund in Zweden. De wetenschappers gebruikten extreem korte lichtflitsen, zogenaamde attosecondepulsen, waarmee de beweging van een elektron voor het eerst kon worden waargenomen. Ook de verdeling van de elektronen in vaste materialen kan worden gevisualiseerd.
Anti-deeltje
Het antideeltje van het elektron wordt positron genoemd. Dit is identiek aan het elektron, maar draagt elektrische en andere ladingen van het tegenovergestelde teken. Wanneer een elektron met een positron botst, kunnen zij van elkaar verstrooien of volledig worden geannihileerd, waarbij een paar (of meer) gammastralen worden geproduceerd.
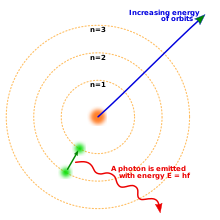
Het Niels Bohr-model van het atoom. Drie elektronenschillen rond een kern, waarbij een elektron van het tweede naar het eerste niveau beweegt en een foton vrijlaat.
Geschiedenis van de ontdekking
De effecten van elektronen waren al bekend lang voordat ze konden worden verklaard. De oude Grieken wisten dat het wrijven van barnsteen tegen de vacht kleine voorwerpen aantrok. Nu weten we dat het wrijven elektronen afvoert, en dat geeft een elektrische lading aan het barnsteen. Veel natuurkundigen werkten aan het elektron. J.J. Thomson bewees dat het bestond, in 1897, maar een andere man gaf het de naam 'elektron'.
Het elektronenwolkmodel
Het model ziet elektronen als onbepaalde posities in een diffuse wolk rond de atoomkern.
Het onzekerheidsprincipe houdt in dat iemand niet tegelijkertijd de positie en het energieniveau van een elektron kan kennen. Deze potentiële toestanden vormen een wolk rond het atoom. De potentiële toestanden van elektronen in één atoom vormen één uniforme wolk.
Gerelateerde pagina's
- Positron
- Proton
- Neutron
Vragen en antwoorden
V: Wat is een elektron?
A: Een elektron is een zeer klein stukje materie, en het is een subatomair deeltje. Het kan niet worden opgesplitst in iets kleiners en heeft een negatieve elektrische lading.
V: Wie heeft het elektron ontdekt?
A: Het elektron werd ontdekt door J.J. Thomson in 1897.
V: Hoeveel massa heeft een elektron?
A: Elektronen hebben heel weinig massa, of gewicht, dus is er heel weinig energie nodig om ze snel te verplaatsen.
V: Aan welk soort interacties nemen elektronen deel?
A: Elektronen nemen deel aan gravitatie, elektromagnetische en zwakke interacties. De elektromagnetische kracht is het sterkst in gewone situaties.
V: Hoe interageren elektronen met elkaar?
A: Elektronen stoten elkaar af omdat ze dezelfde elektrische lading hebben, maar ze worden aangetrokken door protonen omdat die tegengestelde elektrische ladingen hebben.
V: Wat drijft televisies, motoren, mobiele telefoons en vele andere dingen aan?
A: De elektriciteit die deze apparaten aandrijft, bestaat eigenlijk uit vele elektronen die door draden of andere geleiders bewegen.
Zoek in de encyclopedie