Vrij elektronenpaar (lone pair): Definitie, eigenschappen en rol in moleculen
Vrij elektronenpaar (lone pair): heldere definitie, eigenschappen en invloed op molecuulvorm, reactiviteit en bindingsvorming — onmisbaar voor begrip van chemie.
Een lone pair (ook wel vrij elektronenpaar of eenzame paren genoemd) is een paar van twee elektronen dat niet betrokken is bij een chemische binding tussen atomen. Deze elektronen bevinden zich gewoonlijk in de buitenste schil van een atoom, de valentieschil, en samen met de gebonden elektronen bepalen zij het totale aantal valentie-elektronen van het atoom. Vrije elektronenparen hebben vaak een hogere energie dan sterk gebonden elektronen, maar lager dan volledig vrije (geïoniseerde) elektronen.
Eigenschappen en plaatsing
- Niet-bindende aard: Lone pairs nemen geen deel aan een covalente binding tussen twee atomen; ze zijn lokaal rond één atoom geplaatst.
- Ruimtelijke bezetting: Een vrij elektronenpaar neemt doorgaans meer ruimte in dan een bindingspaar. In termen van elektronendichtheid is de niet-bindende wolk dichter bij het atoomkern en oefent zij sterke afstotende krachten uit op andere elektronwolken.
- Hybridorbitalen en richting: In veel moleculen bevinden lone pairs zich in hybride orbitalen (bijvoorbeeld sp3 bij zuurstof in H2O). De vorm en richting van deze orbitalen beïnvloeden de geometrie van het molecuul.
- Energetische niveaus: Lone pairs bezetten zogenaamde niet-bindende (n) orbitaalniveaus. Hun energie en beschikbaarheid maken ze vaak reactief als nucleofiel of base.
Invloed op de molecuulvorm (VSEPR)
De vorm van een molecuul wordt niet alleen bepaald door bindingsparen, maar ook door niet-bindende paren via het VSEPR-model (Valence Shell Electron Pair Repulsion). Omdat lone pairs meer ruimte innemen dan bindingsparen, duwen zij bindingsparen samen en veranderen daardoor hoeken en geometrie. Enkele voorbeelden:
- Water (H2O): twee bindingsparen + twee lone pairs → gebogen (ongeveer 104,5°) in plaats van tetraëdrisch symmetrisch.
- Ammoniak (NH3): drie bindingsparen + één lone pair → gebogen/piramidaal met een H–N–H hoek van ongeveer 107°.
- CO2: zuurstofatomen hebben lone pairs, maar de symmetrische verdeling leidt tot lineaire geometrie van het molecuul als geheel.
Rol in reactiviteit en bindingen
- Nucleofiliciteit en basischheid: Een nucleofiel gebruikt een lone pair om een elektronarm centrum (elektrofiel) aan te vallen. Daarom zijn stoffen met beschikbare lone pairs vaak nucleofielen en/ of basen. Voorbeelden: NH3, OH−, H2O.
- Coördinatie: Lone pairs kunnen coördinatieve (dat wil zeggen dative) bindingen vormen met metalen en andere elektropositieve centra. Liganden in complexen doneren vaak een lone pair aan een metaalcentrum.
- Waterstofbruggen: Lone pairs op zuurstof, stikstof en fluor kunnen waterstofbruggen accepteren, wat grote effecten heeft op fysische eigenschappen zoals kookpunt, oplosbaarheid en structuur van biomoleculen.
- Resonantie en delokalisatie: Lone pairs kunnen soms delocaliseren in een geconjugeerd π-systeem (bijv. in amiden of fenolen), waardoor resonantievormen ontstaan en de basis- of nucleofiliciteit verandert.
Spectroscopie en elektronische overgangen
Lone pairs nemen deel aan elektronische overgangen zoals n→σ* en n→π* in UV/vis- of fotochemische processen. Zulke overgangen verklaren kleur en fotochemische activiteit van sommige verbindingen en zijn belangrijk in organische reacties (bijvoorbeeld fotochemische excitatie van carbonylverbindingen via n→π*).
Lewisstructuren, formele lading en regels
- Bij het tekenen van Lewisstructuren worden lone pairs als paar puntjes aangegeven rond het atoom. Ze zijn belangrijk bij het bepalen van formele lading: meer lone pairs op een atoom verhogen meestal de negatieve formele lading.
- Bij berekening van oktetregels vullen lone pairs de resterende valentieplaats(en) zodat atomen vaak een vol valentieschil (oktetructuur) bereiken, tenzij er uitzonderingen zijn (bv. onvolledige octet of uitgebreid octet).
Bijzondere effecten en uitzonderingen
- Inert pair effect: In sommige zware p-blokelementen (zoals Tl, Pb, Bi) blijven de s-elektronen 'inactief' als een gepaarde set en gedragen ze zich als een inert paar, wat invloed heeft op oxidatiestaten en chemische eigenschappen.
- Stereochemische activiteit en inversie: Sommige lone pairs (bv. op stikstof in aminen) kunnen leiden tot inversie van configuratie (zoals de 'umbrella inversion' bij ammonia), wat invloed heeft op chirale centra en stereochemie.
- Lone pairs op metalen: Transitionele metalen kunnen ook niet-bindende d- of s-elektronenparen hebben die invloed hebben op coördinatiechemie en magnetische eigenschappen.
Voorbeelden in veelvoorkomende moleculen
- H2O: twee lone pairs op zuurstof bepalen polariteit en waterstofbrugvorming.
- NH3: één lone pair op stikstof maakt het een goede Lewis-base en nucleofiel.
- Cl− en andere halide-ionen: vrije elektronenparen bepalen sterkte als nucleofiel/basis en hun coördinatievermogen.
- Carbonylverbindingen (C=O): het zuurstof heeft lone pairs die resonantiedeling en n→π* overgangen mogelijk maken.
Samengevat: lone pairs zijn niet-bindende elektronenparen die grote invloed hebben op de vorm, reactiviteit en fysische eigenschappen van moleculen. Ze bepalen hoe moleculen zich gedragen als basen of nucleofielen, hoe ze binden aan metalen, en hoe zij interageren via waterstofbruggen en resonantie.
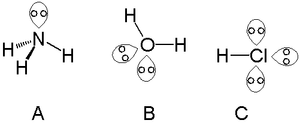
Eenzame paren in ammoniak (A), water (B) en zoutzuur (C)
Zoek in de encyclopedie