Atoom | de meest fundamentele eenheid van materie
Een atoom is de meest elementaire eenheid van materie. Alle normale materie op aarde en overal in het heelal bestaat uit atomen. Dit omvat vaste stoffen, vloeistoffen en gassen. Er zijn een vast aantal verschillende soorten atomen, die chemische elementen worden genoemd. Een atoom is de kleinste eenheid van materie die met andere atomen kan combineren tot moleculen en complexere materie met specifieke chemische eigenschappen.
Atomen zijn zeer klein, maar hun precieze grootte hangt af van het type. Atomen hebben een diameter van 0,1 tot 0,5 nanometer. Eén nanometer is ongeveer 100.000 keer kleiner dan de breedte van een menselijke haar. Dit maakt een atoom onmogelijk te zien zonder speciaal gereedschap. Wetenschappers ontdekken hoe ze werken door experimenten uit te voeren.
Atomen bestaan uit drie soorten subatomaire deeltjes. Dit zijn protonen, neutronen en elektronen. Protonen en neutronen zijn zwaarder en bevinden zich in het midden van het atoom, dat de kern wordt genoemd. De kern is zeer klein en dicht. Hij wordt omringd door lichtgewicht elektronen. Elektronen worden door de elektromagnetische kracht tot de kern aangetrokken, omdat ze tegengestelde elektrische ladingen hebben.
Atomen met hetzelfde aantal protonen zijn hetzelfde chemische element. Ze hebben zeer vergelijkbare eigenschappen. Voorbeelden van elementen zijn waterstof en goud. In de natuur komen ongeveer 92 elementen voor. (Er zijn er meer kunstmatig gemaakt in een laboratorium). Atomen met hetzelfde aantal protonen, maar een verschillend aantal neutronen worden isotopen genoemd. Gewoonlijk heeft een atoom evenveel elektronen als protonen. Als een atoom meer of minder elektronen heeft dan protonen, wordt het een ion genoemd, en heeft het een elektrische lading.
Veel dingen bestaan uit meer dan één soort atoom. Dit zijn chemische verbindingen of mengsels. Atomen kunnen zich verbinden door chemische bindingen te maken. Een groep atomen die door chemische bindingen met elkaar verbonden zijn, wordt een molecuul genoemd. Een watermolecuul bestaat bijvoorbeeld uit twee waterstofatomen en één zuurstofatoom.
Atomen worden slechts zelden gemaakt, vernietigd of veranderd in een ander type atoom. Dit gebeurt als de krachten binnenin te zwak zijn om ze bij elkaar te houden. Deze veranderingen worden bestudeerd in de kernfysica. Bij zeer hoge temperaturen, zoals in een ster, kunnen atomen ook worden samengevoegd tot grotere atomen.
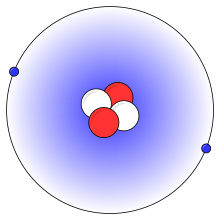
Een vereenvoudigde afbeelding van een heliumatoom, met twee protonen (rood), twee neutronen (wit) en twee elektronen (blauw)
Geschiedenis
Het woord "atoom" komt van het Griekse (ἀτόμος) "atomos", ondeelbaar, van (ἀ)-, niet, en τόμος, een snede. De eerste bekende persoon die het woord "atoom" gebruikte is de Griekse filosoof Democritus, rond 400 voor Christus. Hij geloofde dat alles uit atomen bestond, en dat atomen niet in kleinere stukjes gebroken konden worden. De atoomtheorie was aanvankelijk een filosofisch onderwerp, met weinig echt wetenschappelijk onderzoek of studie, tot de ontwikkeling van de scheikunde in de jaren 1650.
In 1777 definieerde de Franse scheikundige Antoine Lavoisier voor het eerst de term element. Hij zei dat een element elke basisstof was die niet in andere stoffen kon worden afgebroken door de methoden van de scheikunde. Elke stof die wel kan worden afgebroken, is een verbinding.
In 1803 opperde de Engelse filosoof John Dalton dat elementen bestaan uit kleine, vaste bolletjes die atomen worden genoemd. Dalton geloofde dat alle atomen van hetzelfde element dezelfde massa hebben. Hij zei dat verbindingen worden gevormd wanneer atomen van meer dan één element combineren. Volgens Dalton combineren de atomen van de elementen van een bepaalde verbinding altijd op dezelfde manier.
In 1827 bekeek de Britse wetenschapper Robert Brown onder zijn microscoop stuifmeelkorrels in water. De stuifmeelkorrels bleken te bewegen. Brown gebruikte de atoomtheorie van Dalton om patronen te beschrijven in hoe ze bewogen. Dit werd Brownse beweging genoemd. In 1905 gebruikte Albert Einstein wiskunde om te bewijzen dat de stuifmeelkorrels werden bewogen door de beweging, of warmte, van individuele watermoleculen. Daarmee bewees hij onomstotelijk het bestaan van het atoom. In 1869 publiceerde de Russische wetenschapper Dmitri Mendelejev de eerste versie van het periodiek systeem. Het periodiek systeem groepeert elementen op basis van hun atoomnummer (hoeveel protonen ze hebben; dit is meestal hetzelfde als het aantal elektronen). Elementen in dezelfde kolom, of periode, hebben meestal vergelijkbare eigenschappen. Helium, neon, argon, krypton en xenon staan bijvoorbeeld allemaal in dezelfde kolom en hebben zeer vergelijkbare eigenschappen. Al deze elementen zijn gassen die geen kleur of geur hebben. Ook kunnen zij zich niet met andere atomen verbinden tot verbindingen. Samen staan ze bekend als de edelgassen.
De natuurkundige J.J. Thomson was de eerste die elektronen ontdekte. Dit gebeurde toen hij in 1897 met kathodestralen werkte. Hij besefte dat ze een negatieve lading hadden, en dat de atoomkern een positieve lading had. Thomson maakte het pruimenpuddingmodel, dat zei dat een atoom als pruimenpudding was: de gedroogde vruchten (elektronen) zaten vast in een massa pudding (met een positieve lading). In 1909 gebruikte wetenschapper Ernest Rutherford het Geiger-Marsden-experiment om te bewijzen dat het grootste deel van een atoom zich in een zeer kleine ruimte bevindt, de atoomkern. Rutherford nam een fotoplaat en bedekte die met goudfolie. Vervolgens schoot hij er alfadeeltjes (gemaakt van twee protonen en twee neutronen die aan elkaar vastzitten) op. Veel van de deeltjes gingen door de goudfolie heen, wat bewees dat atomen grotendeels uit lege ruimte bestaan. Elektronen zijn zo klein en snelbewegend dat ze de deeltjes niet tegenhielden. Rutherford ontdekte later protonen in de kern.
In 1913 introduceerde Niels Bohr het Bohr-model. Dit model toonde aan dat elektronen in vaste cirkelbanen rond de kern bewegen. Dit was nauwkeuriger dan het model van Rutherford. Het klopte echter nog steeds niet helemaal. Na de invoering van het Bohr-model zijn er nog verbeteringen aangebracht.
In 1925 ontdekte de scheikundige Frederick Soddy dat sommige elementen in het periodiek systeem meer dan één soort atoom hadden, isotopen genoemd. Soddy geloofde dat isotopen van een element een verschillende massa hebben. Om dit te bewijzen bouwde chemicus Francis W. Aston de massaspectrometer, die de massa van individuele atomen meet. Aston bewees dat Soddy gelijk had. Hij ontdekte ook dat de massa van elk atoom een geheel getal maal de massa van het proton is. Dit betekende dat er naast protonen nog een ander deeltje in de kern moest zitten. In 1932 schoot de natuurkundige James Chadwick alfadeeltjes af op berylliumatomen. Hij zag dat er een deeltje uit de berylliumatomen schoot. Dit deeltje had geen lading, maar ongeveer dezelfde massa als een proton. Hij noemde dit deeltje het neutron.
Het meest nauwkeurige model tot nu toe komt van de vergelijking van Schrödinger. Schrödinger leerde dat de elektronen bestaan in een wolk rond de kern, die de elektronenwolk wordt genoemd. In de elektronenwolk is het onmogelijk om precies te weten waar de elektronen zich bevinden. De vergelijking van Schrödinger wordt gebruikt om te bepalen waar een elektron zich waarschijnlijk bevindt. Dit gebied wordt de baan van het elektron genoemd.
In 1937 was de Duitse scheikundige Otto Hahn de eerste die kernsplijting tot stand bracht in een laboratorium. Hij ontdekte dit bij toeval toen hij neutronen afschoot op een uraniumatoom, in de hoop een nieuwe isotoop te maken. Hij merkte echter dat in plaats van een nieuwe isotoop, het uranium veranderde in een bariumatoom, een kleiner atoom dan uranium. Hahn had het uraniumatoom "gebroken". Dit was de eerste geregistreerde kernsplijtingsreactie ter wereld. Deze ontdekking leidde uiteindelijk tot het ontstaan van de atoombom en kernenergie, waarbij de splijting herhaaldelijk plaatsvindt, waardoor een kettingreactie ontstaat.
In de 20e eeuw gingen natuurkundigen dieper in op de mysteries van het atoom. Met behulp van deeltjesversnellers ontdekten zij dat protonen en neutronen bestonden uit andere deeltjes, quarks genaamd.
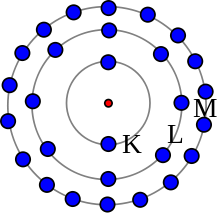
Het Bohr-model is niet nauwkeurig, maar wel nuttig voor het idee van elektronenschillen. Dit atoom heeft 28 elektronen in drie schillen.
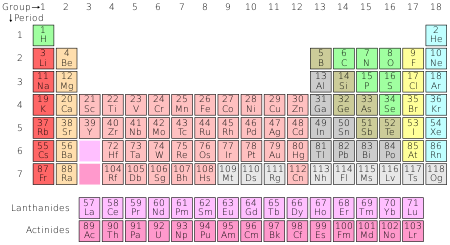
Het periodiek systeem organiseert alle bekende chemische elementen.

Ernest Rutherford
Indeling
Het aantal protonen in een atoom wordt het atoomnummer genoemd. Atomen van hetzelfde element hebben hetzelfde atoomnummer. Alle koolstofatomen hebben bijvoorbeeld zes protonen, dus het atoomnummer van koolstof is zes. Vandaag de dag zijn er 118 elementen bekend. Afhankelijk van hoe men telt, bestaan er 90 tot 94 elementen van nature op aarde. Alle elementen boven nummer 94 zijn alleen door mensen gemaakt. Deze elementen zijn geordend op het periodiek systeem.
Omdat protonen en neutronen ongeveer dezelfde massa hebben, en de massa van elektronen zeer klein is, kunnen we het aantal protonen en neutronen in een atoom het massagetal noemen. De meeste elementen hebben meerdere isotopen met verschillende massagetallen. Om een isotoop een naam te geven, gebruiken we de naam van het element, gevolgd door het massagetal. Zo wordt een atoom met zes protonen en zeven neutronen koolstof-13 genoemd. De gemiddelde massa van alle atomen van een bepaald element wordt zijn atoommassa of atoomgewicht genoemd.
Als de protonen, neutronen of elektronen van een atoom worden verwisseld met andere deeltjes, kunnen exotische atomen worden gemaakt. Experimenten hebben aangetoond dat elk deeltje een tegenpool heeft, een antideeltje genaamd. Samen vormen deze deeltjes antimaterie. Een antimaterie-atoom zou bestaan uit antiprotonen, antineutronen en antielektronen (positronen). Wanneer een deeltje zijn antideeltje ontmoet, worden ze allebei vernietigd. Afgezien daarvan zouden antimaterie-atomen veel kunnen lijken op normale atomen.
Structuur en onderdelen
Onderdelen
Een atoom bestaat uit drie hoofddeeltjes: het proton, het neutron en het elektron. Waterstof-1, een isotoop van waterstof, heeft geen neutronen, maar slechts één proton en één elektron. Een positief waterstofion heeft geen elektronen, maar slechts één proton. Alle andere atomen hebben elk ten minste één proton, één neutron en één elektron.
Elektronen zijn verreweg de kleinste van de drie atomaire deeltjes. Hun grootte is te klein om met de huidige technologie te worden gemeten, en hun massa is ongeveer 9,1×10−28 gram (0,00055 atoommassa-eenheden). Zij hebben een negatieve lading. Protonen en neutronen zijn ongeveer even groot en zwaar, met een massa van ongeveer 1,7×10−24 gram (1 atoommassa-eenheid). Protonen hebben een positieve lading, en neutronen hebben geen lading. De meeste atomen hebben een neutrale lading. Het aantal protonen (positief) en elektronen (negatief) is gelijk, zodat de ladingen elkaar in evenwicht houden. Bij ionen (verschillend aantal elektronen) is dit echter niet het geval, en kunnen ze een positieve of negatieve lading hebben. Protonen en neutronen zijn opgebouwd uit quarks van twee types: opwaartse quarks en neerwaartse quarks. Een proton bestaat uit twee up quarks en één down quark, en een neutron bestaat uit twee down quarks en één up quark.
Kern
De kern bevindt zich in het midden van een atoom. Hij maakt meer dan 99,9% van de massa van het atoom uit. Hij is echter zeer klein: ongeveer 1 femtometer (10−15 m) doorsnee, wat ongeveer 100.000 keer kleiner is dan de breedte van een atoom, en heeft dus een zeer hoge dichtheid. Hij bestaat uit protonen en neutronen. Gewoonlijk stoten in de natuur twee dingen met dezelfde lading elkaar af of schieten ze van elkaar weg. Lange tijd wisten wetenschappers dus niet hoe de positief geladen protonen in de kern bij elkaar bleven. Wij denken nu dat de aantrekkingskracht tussen protonen en neutronen afkomstig is van de sterke wisselwerking.
De sterke wisselwerking is het sterkst over een zeer korte afstand. Op deze afstand wordt zij gedragen door een deeltje dat gluon wordt genoemd. Gluonen werken als lijm om quarks in een proton of neutron aan elkaar te plakken. Over een langere afstand is de sterke wisselwerking zwakker. Deze wordt gedragen door een deeltje dat meson wordt genoemd. Mesonen trekken de protonen en neutronen aan met behulp van de sterke wisselwerking. Zij houden de kern bij elkaar. Deze speciale vorm van de sterke wisselwerking wordt de kernkracht genoemd.
Het aantal neutronen ten opzichte van de protonen bepaalt of de kern stabiel is of radioactief verval ondergaat. Wanneer er te veel neutronen of protonen zijn, probeert het atoom de aantallen kleiner of gelijker te maken door de extra deeltjes te verwijderen. Het doet dit door straling uit te zenden in de vorm van alfa-, bèta- of gammaverval. Kernen kunnen ook op andere manieren veranderen. Bij kernsplijting breekt de kern in twee kleinere kernen, waarbij veel energie vrijkomt. Dit vrijkomen van energie maakt kernsplitsing nuttig voor het maken van bommen en elektriciteit in de vorm van kernenergie. De andere manier waarop kernen kunnen veranderen is door kernfusie, wanneer twee kernen samensmelten tot een grotere kern. Dit proces vereist extreme hoeveelheden energie om de elektrostatische afstoting tussen de protonen, die dezelfde lading hebben, te overwinnen. Dergelijke hoge energieën komen het meest voor in sterren zoals onze zon, die waterstof smelt als brandstof. Zodra de fusie echter plaatsvindt, komt er veel meer energie vrij doordat een deel van de massa wordt omgezet in energie.
Elektronen
Elektronen draaien rond de kern. Ze worden de elektronenwolk van het atoom genoemd. Ze worden aangetrokken door de kern vanwege de elektromagnetische kracht. Elektronen hebben een negatieve lading, en de kern heeft altijd een positieve lading, dus trekken ze elkaar aan.
Volgens het Bohr-model bevinden sommige elektronen zich verder van de kern dan andere in verschillende lagen. Deze worden elektronenschillen genoemd. We hebben geleerd dat alleen de elektronen in de buitenste schil chemische bindingen kunnen aangaan. Het aantal elektronen in de buitenste schil bepaalt of het atoom stabiel is en met welke atomen het zich in een chemische reactie zal verbinden. Als een atoom slechts één schil heeft, heeft het twee elektronen nodig om compleet te zijn. Anders heeft de buitenste schil acht elektronen nodig om compleet te zijn.
Het Bohr-model is belangrijk omdat het het idee van energieniveaus heeft. De elektronen in elke schil hebben een bepaalde hoeveelheid energie. Schillen die verder van de kern verwijderd zijn, hebben meer energie. Wanneer een kleine energie-uitbarsting, een foton genaamd, een elektron raakt, kan het elektron naar een hogere energieschil springen. Dit foton moet precies de juiste hoeveelheid energie bevatten om het elektron naar het nieuwe energieniveau te brengen. Een foton is een uitbarsting van licht, en de hoeveelheid energie bepaalt de kleur van het licht. Elk type atoom absorbeert dus bepaalde kleuren licht, het zogenaamde absorptiespectrum. Een elektron kan ook een foton uitzenden, of uitzenden, en in een lagere energieschil vallen. Om soortgelijke redenen zendt het atoom alleen bepaalde kleuren licht uit, het zogenaamde emissiespectrum.
Het volledige plaatje is ingewikkelder. In tegenstelling tot de aarde die rond de zon beweegt, bewegen elektronen niet in een cirkel. Wij kunnen de exacte plaats van een elektron niet kennen. Wij kennen alleen de waarschijnlijkheid, of de kans, dat het zich op een bepaalde plaats bevindt. Elk elektron maakt deel uit van een baan, die beschrijft waar het waarschijnlijk zal zijn. Niet meer dan twee elektronen kunnen zich in één baan bevinden; deze twee elektronen hebben een verschillende spin.
Voor elke schil, genummerd 1, 2, 3, enzovoort, kunnen er meerdere orbitalen zijn met verschillende vormen. De soorten banen krijgen letters: s, p, d en f. Er kunnen ook verschillende banen zijn voor één cijfer- en lettercombinatie. Als er meer elektronen worden toegevoegd, voegen zij zich bij orbitalen in volgorde van laagste naar hoogste energie. Deze volgorde begint als volgt: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d. Een chlooratoom bijvoorbeeld heeft 17 elektronen. Het heeft dus 2 elektronen in de 1s-baan, 2 elektronen in de 2s-baan, 6 elektronen in de 2p-baan, 2 elektronen in de 3s-baan en 5 elektronen in de 3p-baan. Met andere woorden, het heeft 2 elektronen in de eerste schil, 8 in de tweede schil en 7 in de derde schil.

Vormen van verschillende orbitalen rond een atoom
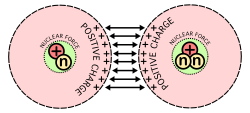
Een afbeelding van de belangrijkste moeilijkheid bij kernfusie: Protonen, die een positieve lading hebben, stoten elkaar af wanneer ze worden samengedrukt.
Eigenschappen
Grootte en massa
De grootte van een atoom hangt af van de grootte van zijn elektronenwolk. Naar beneden in het periodiek systeem worden meer elektronenschillen toegevoegd. Daardoor worden atomen groter. Naar rechts in het periodiek systeem worden meer protonen aan de kern toegevoegd. Er worden echter geen elektronenschillen toegevoegd. Deze positievere kern trekt sterker aan elektronen, waardoor atomen kleiner worden. Het grootste atoom is cesium, dat volgens één model ongeveer 0,596 nanometer breed is. Het kleinste atoom is helium, dat ongeveer 0,062 nanometer breed is.
De massa van atomen varieert van 1,7×10−24 tot 4,9×10 −22gram. Meestal wordt de massa gemeten met de atoommassa-eenheid (amu), ook wel dalton genoemd. Eén amu is precies 1/12 van de massa van een koolstof-12 atoom, die 1,7×10−24 gram bedraagt. Waterstof-1 heeft een massa van ongeveer 1 amu, en het zwaarste bekende atoom, oganesson, heeft een massa van ongeveer 294 amu.
Hoe atomen op elkaar inwerken
Als atomen ver uit elkaar liggen, trekken ze elkaar aan. Deze aantrekkingskracht is voor sommige soorten atomen sterker dan voor andere. Tegelijkertijd zorgt de warmte, of kinetische energie, van atomen ervoor dat ze voortdurend bewegen. Als de aantrekkingskracht sterk genoeg is in verhouding tot de hoeveelheid warmte, vormen de atomen een vaste stof. Als de aantrekkingskracht zwakker is, vormen ze een vloeistof, en als de aantrekkingskracht nog zwakker is, vormen ze een gas.
Chemische bindingen zijn de sterkste vormen van aantrekkingskracht tussen atomen. Bij alle chemische bindingen worden elektronen verplaatst. Atomen verbinden zich gewoonlijk met elkaar op een manier die hun buitenste elektronenschil vult of leegt. De meest reactieve elementen moeten een klein aantal elektronen verliezen of winnen om een volle buitenste schil te hebben. Atomen met een volle buitenste schil, edelgassen genoemd, vormen gewoonlijk geen bindingen.
Er zijn drie belangrijke soorten bindingen: ionische bindingen, covalente bindingen en metaalbindingen.
- Bij een ionische binding geeft een atoom elektronen aan een ander atoom. Elk atoom wordt een ion: een atoom of groep atomen met een positieve of negatieve lading. Het positieve ion (dat elektronen heeft verloren) wordt een kation genoemd; het is meestal een metaal. Het negatieve ion (dat elektronen heeft gewonnen) wordt een anion genoemd; het is meestal een niet-metaal. Ionische binding resulteert meestal in een rooster, of kristal, van bij elkaar gehouden ionen.
- Bij een covalente binding delen twee atomen elektronen. Dit gebeurt meestal wanneer beide atomen niet-metalen zijn. Covalente bindingen vormen vaak moleculen, variërend in grootte van twee atomen tot veel meer. Ze kunnen ook grote netwerken vormen, zoals glas of grafiet. Het aantal bindingen dat een atoom maakt (zijn valentie) is meestal het aantal elektronen dat nodig is om zijn buitenste elektronenschil te vullen.
- In een metaalbinding bewegen elektronen vrij tussen vele metaalatomen. Elk aantal atomen kan zich op deze manier binden. Metalen geleiden elektrische stroom omdat er gemakkelijk elektrische lading doorheen kan stromen. Atomen in metalen kunnen langs elkaar heen bewegen, zodat metalen gemakkelijk kunnen worden gebogen, uitgerekt en vervormd.
Alle atomen trekken elkaar aan door Van der Waals-krachten, die zwakker zijn dan chemische bindingen. Deze krachten worden veroorzaakt wanneer elektronen naar één kant van een atoom bewegen. Deze beweging geeft een negatieve lading aan die kant. Het geeft ook een positieve lading aan de andere kant. Wanneer twee atomen hun zijden met negatieve en positieve lading op één lijn brengen, trekken ze elkaar aan.
Ondanks het feit dat atomen voornamelijk uit lege ruimte bestaan, kunnen zij elkaar niet passeren. Wanneer twee atomen zich zeer dicht bij elkaar bevinden, zullen hun elektronenwolken elkaar afstoten door de elektromagnetische kracht.
Magnetisme
Een elektron heeft een eigenschap die magnetisch moment wordt genoemd en die een richting en een grootte (of omvang) heeft. Het magnetisch moment komt voort uit de individuele spin van het elektron en zijn baan rond de kern. Samen vormen de magnetische momenten van de elektronen een magnetisch moment voor het hele atoom. Dit verklaart het gedrag van atomen in een magnetisch veld.
Elk elektron in een atoom heeft een van de twee soorten spin. Als elk elektron wordt gekoppeld aan een elektron met de tegenovergestelde spin, heffen de spins op, zodat het atoom geen blijvend magnetisch moment heeft. Dergelijke atomen worden diamagnetisch genoemd: ze worden slechts zwak afgestoten door een magnetisch veld.
Als sommige elektronen echter niet gekoppeld zijn, heeft het atoom een blijvend magnetisch moment: het is dan paramagnetisch of ferromagnetisch. Wanneer atomen paramagnetisch zijn, wijst het magnetisch moment van elk atoom in een willekeurige richting. Ze worden zwak aangetrokken door een magnetisch veld. Wanneer atomen ferromagnetisch zijn, werken de magnetische momenten van nabijgelegen atomen op elkaar in. Ze wijzen in dezelfde richting. In een magnetisch veld zullen de meeste atomen in de richting van het veld wijzen. Ferromagnetische materialen, zoals ijzer, kobalt en nikkel, worden sterk aangetrokken door een magnetisch veld.
Radioactief verval
Sommige elementen, en veel isotopen, hebben een zogenaamde onstabiele kern. Dit betekent dat de kern ofwel te groot is om zichzelf bij elkaar te houden, ofwel te veel protonen of neutronen heeft. Wanneer dit gebeurt, moet de kern de overtollige massa aan deeltjes verwijderen. Dit doet hij door middel van straling. Een atoom dat dit doet, wordt radioactief genoemd. Instabiele atomen zenden straling uit totdat ze genoeg deeltjes in de kern verliezen om stabiel te worden. Alle atomen boven atoomnummer 82 (82 protonen, lood) zijn radioactief.
Er zijn drie belangrijke soorten radioactief verval: alfa, bèta en gamma.
- Bij alfaverval schiet het atoom een deeltje met twee protonen en twee neutronen naar buiten. Dit is in wezen een heliumkern. Het resultaat is een element met een atoomnummer twee minder dan voorheen. Als bijvoorbeeld een berylliumatoom (atoomnummer 4) een alfaverval doormaakt, wordt het helium (atoomnummer 2). Alfaverval treedt op wanneer een atoom te groot is en zich van wat massa moet ontdoen.
- Bij bètaverval verandert een neutron in een proton, of een proton in een neutron. In het eerste geval schiet het atoom een elektron uit. In het tweede geval is het een positron (zoals een elektron, maar met een positieve lading). Het resultaat is een element met één hoger of één lager atoomnummer dan voorheen. Bètaverval treedt op wanneer een atoom te veel protonen of te veel neutronen heeft.
- Er is sprake van gammaverval wanneer een atoom een gammastraal, of golf, uitstraalt. Dit gebeurt wanneer de energie van de kern verandert. Dit gebeurt meestal nadat een kern het alfa- of bètaverval heeft doorlopen. Er is geen verandering in de massa of het atoomnummer van het atoom, alleen in de opgeslagen energie in de kern, in de vorm van de spin van de deeltjes.
Elk radioactief element of isotoop heeft een halveringstijd. Dit is hoe lang het duurt voordat de helft van een monster atomen van dat type vervalt tot ze een ander isotoop of element worden.
Splijting en fusie
Apparaten die gebruik maken van kernsplijting beginnen met het afschieten van neutronen op atomen. Hierdoor valt het atoom snel uit elkaar. De splitsing van één atoom schiet meer neutronen af, die vervolgens andere atomen breken, waardoor kettingreacties ontstaan. Dit proces levert enorme hoeveelheden warmte-energie op. De kettingreactie van kernsplijting dreef de eerste kernwapens (splijtingsbommen) aan. Kerncentrales zijn een beetje anders: er worden zogenaamde regelstaven gebruikt om de splijting te vertragen. Regelstaven vangen een deel van de neutronen op, waardoor een kettingreactie wordt voorkomen.
Kernfusie komt vooral voor in de zon en andere sterren. Het vereist een hete plaats, maar levert nog meer energie op dan kernsplijting. Dit verklaart de hitte en het licht van de zon. De zon fuseert nu waterstof tot helium, terwijl grotere en hetere sterren zwaardere atomen maken. Fusiebommen, of thermonucleaire wapens, zijn de krachtigste kernwapens. Wetenschappers proberen fusiereactoren te maken voor kerncentrales, maar er bestaat nog geen enkele.
Kernfusie en kernsplijting produceren om vergelijkbare redenen energie. Volgens Einsteins beroemde formule E = mc2 kan een kleine hoeveelheid massa worden omgezet in een grote hoeveelheid energie. Wanneer protonen en neutronen bij kernfusie samenkomen, verliezen ze wat massa, die ze als energie uitzenden. De kern kan zich alleen splitsen in zijn protonen en neutronen als dezelfde hoeveelheid energie wordt toegevoegd. Deze eigenschap van elk type kern wordt zijn nucleaire bindingsenergie genoemd. Fusie of splitsing zenden energie uit als de totale bindingsenergie toeneemt. Kernen in het bereik van ijzer-56 en nikkel-62 hebben de hoogste bindingsenergie gedeeld door hun aantal protonen en neutronen, zodat zij over het algemeen geen splitsing of fusie ondergaan. Grotere atomen, zoals uranium, ondergaan kernsplijting, omdat hun bindingsenergie daardoor toeneemt.
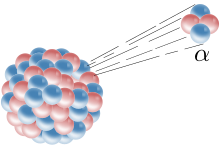
Een alfadeeltje schiet uit een kern.
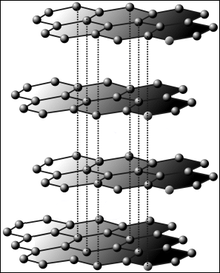
Grafiet bestaat uit koolstofatomen in lagen. Elke laag wordt bijeengehouden door covalente bindingen. De aantrekkingskracht tussen de verschillende lagen is een Van der Waals-kracht.
Ontstaan en voorkomen
Bijna alle waterstofatomen in het heelal, de meeste heliumatomen en sommige lithiumatomen werden kort na de oerknal gemaakt. Ook nu nog bestaat ongeveer 90% van alle atomen in het heelal uit waterstof. Grotere atomen worden in sterren gemaakt door kernfusie, terwijl de grootste atomen worden gemaakt in zeer massieve sterren of supernovae. De meeste atomen op aarde zijn gemaakt door een ster die bestond vóór de zon.
Men maakt zeer grote atomen door kleinere atomen in deeltjesversnellers samen te smelten. Deze atomen vervallen echter vaak zeer snel. Oganesson (element 118) heeft een halveringstijd van 0,89 milliseconden. Het is mogelijk dat in de toekomst nog grotere atomen worden gemaakt.
Gerelateerde pagina's
- Atoomfysica, voor meer details over de fysica van atomen
- Chemie, het gebied dat alle dingen bestudeert die van atomen zijn gemaakt
- Elementaire deeltjes, de deeltjes waaruit atomen en al het andere bestaat.
- Kwantummechanica, de studie van kleine deeltjes en hun interactie met energie
- Staten van materie, de verschillende vormen waarin atomen of moleculen kunnen voorkomen
Vragen en antwoorden
V: Wat is een atoom?
A: Een atoom is de meest elementaire eenheid van materie. Het is de kleinste eenheid van materie die zich met andere atomen kan combineren tot moleculen en complexere materie met specifieke chemische eigenschappen.
V: Hoe groot zijn atomen?
A: Atomen zijn zeer klein, met een diameter van 0,1 tot 0,5 nanometer, wat ongeveer 100.000 keer kleiner is dan de breedte van een menselijke haar.
V: Wat zijn de drie soorten subatomaire deeltjes waaruit een atoom bestaat?
A: De drie soorten subatomaire deeltjes waaruit een atoom bestaat zijn protonen, neutronen en elektronen. Protonen en neutronen zijn zwaarder en bevinden zich in de kern, terwijl elektronen lichter zijn en door elektromagnetische kracht door hun tegengestelde elektrische ladingen door de kern worden aangetrokken.
V: Hoeveel elementen komen van nature voor in de wereld?
A: Ongeveer 92 elementen komen in de natuur voor.
V: Wat gebeurt er als een atoom meer of minder elektronen dan protonen heeft?
A: Als een atoom meer of minder elektronen dan protonen heeft, wordt het een ion genoemd en heeft het een elektrische lading.
V: Wat voor soort veranderingen gebeuren er als de krachten in atomen te zwak worden om ze bij elkaar te houden?
A: Als de krachten in atomen te zwak worden om ze bij elkaar te houden, kunnen ze veranderen in een ander type atoom of helemaal vernietigd worden; dit proces wordt bestudeerd in de kernfysica.
Zoek in de encyclopedie