Isotopen van waterstof
Waterstof heeft drie belangrijke isotopen: protium (1H), deuterium (2H) en tritium (3H). Deze isotopen komen van nature voor in de natuur. Protium en deuterium zijn stabiel. Tritium is radioactief en heeft een halveringstijd van ongeveer 12 jaar. Wetenschappers hebben nog vier andere waterstofisotopen (4H tot 7H) gemaakt, maar deze isotopen zijn zeer instabiel en bestaan niet in de natuur.
De belangrijkste isotopen van waterstof zijn uniek omdat zij de enige isotopen zijn die een naam hebben. Deze namen zijn nog steeds in gebruik. Deuterium en tritium krijgen soms hun eigen symbolen, D en T. De Internationale Unie voor Zuivere en Toegepaste Scheikunde is echter niet erg gecharmeerd van deze namen, ook al worden ze vaak gebruikt. Er zijn nog andere isotopen die hun eigen naam hadden toen wetenschappers radioactiviteit bestudeerden. Maar hun namen worden vandaag niet meer gebruikt.
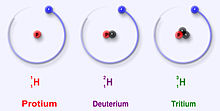
De drie meest stabiele isotopen van waterstof
Protium (waterstof-1)
Protium is de meest voorkomende isotoop van waterstof. Het maakt meer dan 99,98% uit van alle waterstof in het heelal. Het wordt protium genoemd omdat zijn kern slechts één proton heeft. Protium heeft een atoommassa van 1,00782504(7) u. Het symbool voor protium is 1H.Het proton van protium is bij een waarneming nog nooit vervallen, zodat wetenschappers denken dat protium een stabiele isotoop is. Nieuwe theorieën van de deeltjesfysica voorspellen dat een proton kan vervallen, maar dit verval is zeer traag. Men zegt dat het proton een halfwaardetijd van 1036 jaar heeft. Als het protonverval waar is, dan zijn alle andere kernen waarvan gezegd wordt dat ze stabiel zijn, eigenlijk alleen maar waarneembaar stabiel, d.w.z. ze zien eruit alsof ze stabiel zijn. Recente experimenten hebben aangetoond dat als het protonverval inderdaad optreedt, het een halfwaardetijd van 6,6 × 1033 jaar zou hebben.
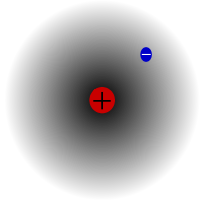
Protium, de meest voorkomende isotoop van waterstof. Het is bijzonder omdat het de enige isotoop is die geen neutron heeft.
Deuterium (waterstof-2)
Deuterium, of 2H of soms D, is een andere stabiele isotoop van waterstof. De isotoop heeft één proton en één neutron. Het maakt ongeveer 0,0026 - 0,0184% uit van alle waterstofatomen op aarde. Deuterium komt minder voor in waterstofgas op aarde en meer in zeewater (0,015% of 150 ppm). Deuterium is niet radioactief, en het is niet schadelijk voor levende wezens. Deuterium kan ook watermoleculen vormen. Water met deuterium in plaats van protium wordt zwaar water genoemd.
Tritium (waterstof-3)
Tritium (3H) is de meest stabiele radio-isotoop van waterstof. Dat wil zeggen dat van alle radioactieve isotopen van waterstof, tritium het minst radioactief is. Het heeft een proton en 2 neutronen in zijn kern. Tritium vervalt door beta minus verval en verandert in helium-3. Het heeft een halveringstijd van 12,32 jaar.Tritium wordt op natuurlijke wijze gevormd door de wisselwerking tussen de gassen in de bovenste atmosfeer en kosmische stralen. Het ontstaat ook bij kernwapenproeven. Tritium en deuterium worden gebruikt bij D-T kernfusie in sterren om veel energie af te geven.
Vragen en antwoorden
V: Hoeveel hoofdisotopen van waterstof zijn er?
A: Er zijn drie hoofdisotopen van waterstof: protium, deuterium en tritium.
V: Zijn protium en deuterium stabiele isotopen?
A: Ja, protium en deuterium zijn stabiele isotopen.
V: Wat is de halveringstijd van tritium?
A: Tritium is radioactief en heeft een halveringstijd van ongeveer 12 jaar.
V: Hoeveel andere waterstofisotopen hebben wetenschappers gemaakt?
A: Wetenschappers hebben vier andere waterstofisotopen gemaakt: 4H tot 7H.
V: Bestaan deze vier extra waterstofisotopen in de natuur?
A: Nee, deze isotopen zijn erg onstabiel en bestaan niet in de natuur.
V: Wat maakt de hoofdisotopen van waterstof uniek?
A: De hoofdisotopen van waterstof zijn uniek omdat zij de enige isotopen zijn die een naam hebben.
V: Hebben deuterium en tritium hun eigen symbolen?
A: Ja, deuterium en tritium krijgen soms hun eigen symbolen: D en T. De International Union of Pure and Applied Chemistry houdt echter niet zo van deze namen, ook al worden ze vaak gebruikt.
Zoek in de encyclopedie