Wet van Boyle
De wet van Boyle (ook wel de wet van Mariotte en de wet van Boyle-Mariotte genoemd) is een wet over ideale gassen.
De wet kan als volgt worden weergegeven:
Voor een vaste hoeveelheid van een ideaal gas dat op een vaste temperatuur wordt gehouden, zijn P (druk) en V (volume) omgekeerd evenredig.
Met andere woorden, het volume van een constante massa ideaal gas bij een constante temperatuur is omgekeerd evenredig met de druk die erop wordt uitgeoefend.
In symbolen, is de wet:
P ∝ 1 V. Ppropto
of
P V = k {\\\playstyle PV=k}
waarbij P de druk van het gas is, V het volume van het gas en k een constante.
Voor een bepaalde gasmassa bij een constante temperatuur is het product van de druk en het volume een constante. Naarmate het volume afneemt, neemt de druk evenredig toe, en omgekeerd. Als de druk bijvoorbeeld halveert, verdubbelt het volume.
Stel dat je een tank hebt die een bepaalde hoeveelheid gas bevat bij een bepaalde druk. Wanneer je het volume van de tank verlaagt, wordt hetzelfde aantal gasdeeltjes nu in een kleinere ruimte opgeslagen. Hierdoor neemt het aantal botsingen toe. De druk is dus groter.
Stel je voor dat je een gas hebt bij een bepaalde druk (P1) en een bepaald volume (V1). Als u de druk wijzigt naar een nieuwe waarde (P2), verandert het volume in een nieuwe waarde (V2). We kunnen de wet van Boyle gebruiken om beide sets van voorwaarden te beschrijven:
P 1 V 1 = k {\playstyle P_{1}V_{1}=k}
P 2 V 2 = k {\playstyle P_{2}V_{2}=k}
De constante, k, is in beide gevallen hetzelfde, dus we kunnen het volgende zeggen:
P 1 V 1 = P 2 V 2 {\playstyle P_{1}V_{1}=P_{2}V_{2}}}
Voorbeeld: De druk van een gas is 3 atm en het volume is 5 liter. Als de druk wordt teruggebracht tot 2 atm, wat is dan het volume?
P 1 V 1 = P 2 V 2 {\playstyle P_{1}V_{1}=P_{2}V_{2}}}
V 2 = P 1 V 1 P 2 {\\frac {P_{1}V_1}}{P_{2}}}}}={\frac {P_{1}}
V 2 = 3 ∗ 5 2 {displaystyle V_{2}={frac {3*5}{2}}}
V 2 = 15 2. V_2={\frac {15}{2}}
V 2 = 7,5 {\playstyle V_{2}=7,5}
∴ Het volume zal 7,5 liter zijn.
De wet werd in 1662 door Robert Boyle gevonden, en daarna in 1679 zelfstandig door Edme Mariotte.
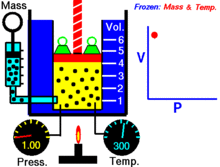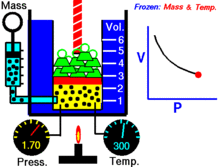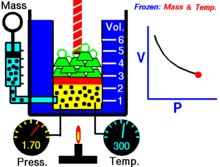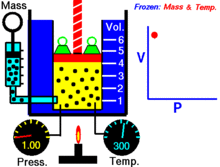
Een animatie die de relatie tussen druk en volume laat zien. De hoeveelheid en de temperatuur van het gas zijn constant.
Vragen en antwoorden
V: Wat is de wet van Boyle?
A: De wet van Boyle (ook wel de wet van Mariotte en de wet van Boyle-Mariotte genoemd) is een wet over ideale gassen die stelt dat voor een vaste hoeveelheid van een ideaal gas bij een constante temperatuur, de druk (P) en het volume (V) omgekeerd evenredig zijn.
V: Hoe kunnen we de wet van Boyle wiskundig uitdrukken?
A: Wij kunnen de Wet van Boyle wiskundig uitdrukken als P ∝ 1/V of PV = k, waarbij P de druk van het gas is, V het volume van het gas, en k een constante is.
V: Wie heeft deze wet ontdekt?
A: De wet werd ontdekt door Robert Boyle in 1662, en daarna onafhankelijk door Edme Mariotte in 1679.
V: Wat betekent het als wij zeggen dat P en V omgekeerd evenredig zijn?
A: Dit betekent dat als de ene toeneemt, de andere evenredig afneemt - dus als u het volume van een tank met een bepaalde hoeveelheid gas bij een bepaalde druk verlaagt, zal de druk toenemen als gevolg van de toegenomen botsingen tussen deeltjes doordat zij zich in minder ruimte bevinden.
V: Hoe kunnen wij de Wet van Boyle gebruiken om veranderingen in druk of volume te berekenen?
A: Wij kunnen de Wet van Boyle gebruiken om veranderingen in druk of volume te berekenen met behulp van twee vergelijkingen - P1V1=k en P2V2=k - waarbij k constant blijft en P1/V1 of P2/V2 verandert, afhankelijk van wat u probeert te berekenen.
V: Kunnen we deze wet ook toepassen op echte gassen?
A: Nee - dit geldt alleen voor ideale gassen, omdat die geen intermoleculaire krachten onderling hebben.
Zoek in de encyclopedie








