Activeringsenergie (Ea) in de chemie — Definitie & uitleg
Activeringsenergie (Ea) uitgelegd: heldere definitie, betekenis, formule en voorbeelden voor chemische reacties — begrijp snel de energiebarrière en berekeningen.
De activeringsenergie van een chemische reactie is de minimale energie die nodig is om de reactie te laten plaatsvinden. Zij heeft gewoonlijk het symbool Ea en wordt gemeten in kilojoule per mol. Zij kan worden beschouwd als een barrière tussen de reagentia en de producten van een reactie. De activeringsenergie is het verschil in energie tussen de overgangstoestand en de uitgangsreagentia.
Wat betekent dit in de praktijk?
Een hogere Ea betekent dat minder deeltjes genoeg energie hebben om de barrière te overwinnen bij een bepaalde temperatuur, en de reactie daarom langzamer verloopt. Een lagere Ea maakt het eenvoudiger voor de reactie om te starten en verhoogt bij gelijke omstandigheden de reactiesnelheid. Belangrijk is dat Ea iets zegt over de kinetiek (hoe snel iets gebeurt), niet rechtstreeks over de energieverandering (thermodynamica) tussen beginstoffen en producten.
Formule en temperatuurafhankelijkheid
De temperatuurafhankelijkheid van de reactiesnelheid wordt vaak beschreven met de Arrhenius-vergelijking:
k = A · e-Ea/(R·T)
Hierin is k de reactiesnelheidsconstante, A de frequentiefactor (een maat voor de botsingsfrequentie en oriëntatie), R de gasconstante (R = 8,314 J·mol-1·K-1) en T de absolute temperatuur in kelvin. Omdat Ea meestal in kJ·mol-1 wordt gegeven, moet men die omzetten naar J·mol-1 (1 kJ = 1000 J) wanneer R in J·mol-1·K-1 gebruikt wordt.
Hoe bepaalt men Ea experimenteel?
- Meet de snelheidsconstante k bij verschillende temperaturen.
- Maak een Arrhenius-plot: plot ln(k) tegen 1/T.
- De grafiek is doorgaans lineair en de helling is -Ea/R; uit de helling volgt dus Ea.
Relatie met reactiewarmte en omgekeerde reactie
Ea is geen maat voor of een reactie wel of niet spontaan is; daarvoor gebruikt men de Gibbs-energie of reactiewarmte (ΔH). Voor de omgekeerde reactie geldt: Ea, vooruit − Ea, achteruit = ΔH (nadat dezelfde eenheden gebruikt zijn). Met andere woorden: als de voorwaartse en achterwaartse activeringsenergieën bekend zijn, geeft hun verschil de enthalpieverandering van de reactie.
Rol van katalysatoren
Een katalysator verlaagt de activeringsenergie door een alternatieve reactieroute met een lagere overgangstoestand te bieden. Dit verhoogt de reactiesnelheid zonder de thermodynamische eigenschappen van de reactie (zoals ΔH of de evenwichtsconstante) te veranderen. Katalysatoren worden veel gebruikt in de industrie en in biologische systemen (enzymen) om reacties bij lagere temperaturen en sneller te laten verlopen.
Praktische voorbeelden en aanvullende opmerkingen
- Typische waarden van Ea liggen vaak tussen enkele tientallen en enkele honderden kJ·mol-1, afhankelijk van het type reactie.
- Als vuistregel: bij Ea van ongeveer 50–70 kJ·mol-1 kan een temperatuurstijging van ~10 °C de reactiesnelheid ongeveer verdubbelen (dit is echter slechts een grove benadering en hangt van Ea af).
- In sommige zeer lichtdeeltjesoverdrachten (bijvoorbeeld waterstof) kan kwantumtunneling een rol spelen; dat leidt tot afwijkingen van klassieke verwachtingen en lijkt de effectieve Ea te verlagen.
Samenvatting
De activeringsenergie Ea is de energetische drempel die reagentia moeten overwinnen om via een overgangstoestand naar producten te gaan. Zij bepaalt, via de Arrhenius-relatie, hoeveel de reactiesnelheid afhankelijk is van de temperatuur. Katalysatoren verlagen Ea en versnellen zo reacties zonder de eindtoestand (thermodynamica) te wijzigen.
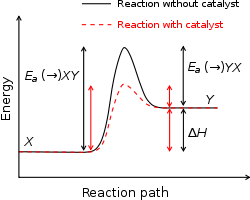
Activeringsenergie met en zonder katalysator
Arrhenius vergelijking
Deze vergelijking is een manier om de activeringsenergie te berekenen. De vorm is:
k = A e - E a / R T {\displaystyle k=Ae^{{-E_{a}}/{RT}}}
Hierin is k de snelheidsconstante van de reactie (die kan worden gemeten met behulp van chemische kinetiek), A een frequentiefactor, R de universele gasconstante, T de temperatuur. Als we meten hoe snel de reactie verloopt bij verschillende temperaturen, dan kunnen we een grafiek maken en met behulp van deze vergelijking de activeringsenergie berekenen.
Katalyse
Bij gebruik van een katalysator wordt de activeringsenergie kleiner. Dit betekent dat de reactie sneller kan verlopen bij dezelfde temperatuur. De katalysator verandert de energie van de reagentia en de producten niet. Ook verandert de katalysator niet tijdens de reactie. Daarom kan hij steeds opnieuw worden gebruikt en is slechts een kleine hoeveelheid katalysator nodig.
Zoek in de encyclopedie
