Chemische kinetiek
Chemische kinetiek, ook wel reactiekinetiek genoemd, bestudeert hoe snel chemische reacties verlopen. Hierbij wordt bestudeerd hoe verschillende omstandigheden, zoals temperatuur, druk of het gebruikte oplosmiddel, de snelheid van een reactie beïnvloeden. Chemische kinetiek kan ook worden gebruikt om meer te weten te komen over reactiemechanismen en overgangstoestanden.
Het basisidee van de chemische kinetiek wordt de botsingstheorie genoemd. Deze stelt dat een reactie alleen kan plaatsvinden als de moleculen elkaar raken. Manieren om de snelheid van de reactie te verhogen moeten dus het aantal treffers verhogen. Dit kan op vele manieren.
Met experimenten kunt u reactiesnelheden berekenen, waaruit u snelheidswetten en snelheidsconstanten kunt afleiden. Een snelheidswet is een wiskundige uitdrukking waarmee u de snelheid van een reactie kunt berekenen, gegeven de concentratie van de reagentia.
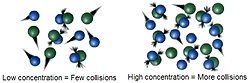
Bij een hogere concentratie zullen de moleculen elkaar gemakkelijker raken en dus zal de snelheid van de reactie groter zijn.
Volgorde van een reactie
het evenwicht is dynamisch van aard
Er zijn vele soorten tariefwetten, maar de meest voorkomende zijn:
- nul-orde reactie: de snelheid hangt niet af van de concentratie
- eerste-orde-reactie: de snelheid hangt af van de concentratie van slechts één reactant
- reactie van de tweede orde: de snelheid hangt af van de concentratie van twee reactanten, of van de concentratie van één reactant in het kwadraat.
Op basis van deze gegevens kan worden nagedacht over het mechanisme van de reactie. Als het bijvoorbeeld tweede orde is, dan is het waarschijnlijk dat beide moleculen in de reactie bij elkaar komen tijdens de snelheidsbepalende stap. Dit is de moeilijkste stap in het mechanisme, omdat deze de hoogste activeringsenergie heeft.
| Basis reactiemechanismen | |
| Nucleofiele substitutie | Unimoleculaire nucleofiele substitutie (SN 1) - Bimoleculaire nucleofiele substitutie (SN 2) - Nucleofiele aromatische substitutie (SN Ar) - Nucleofiele interne substitutie (SN i) |
| Unimoleculaire eliminatie (E1) - E1cB eliminatiereactie - Bimoleculaire eliminatie (E2) | |
| Elektrofiele additie - Nucleofiele additie - Vrije radicale additie - Cycloadditie | |
| Gerelateerde onderwerpen | Elementaire reactie - Moleculariteit - Stereochemie - Katalyse - Botsingstheorie - Oplosmiddeleffecten - Pijlstoten |
| Chemische kinetiek | |
Vragen en antwoorden
V: Wat is chemische kinetiek?
A: Chemische kinetiek, ook wel reactiekinetiek genoemd, is de studie van hoe snel chemische reacties verlopen en hoe verschillende omstandigheden, zoals temperatuur, druk of het gebruikte oplosmiddel, de snelheid van een reactie beïnvloeden.
V: Wat zegt de botsingstheorie?
A: De botsingstheorie stelt dat een reactie alleen kan plaatsvinden als de moleculen elkaar raken. Manieren om de snelheid van de reactie te verhogen moeten dus het aantal treffers verhogen.
V: Hoe kunt u reactiesnelheden berekenen?
A: Met experimenten is het mogelijk reactiesnelheden te berekenen, waaruit u snelheidswetten en snelheidsconstanten kunt afleiden.
V: Wat is een snelheidswet?
A: Een snelheidswet is een wiskundige uitdrukking waarmee u de snelheid van een reactie kunt berekenen, gegeven de concentratie van de reagentia.
V: Hoe kunt u de snelheid van een reactie verhogen?
A: De snelheid van een reactie kan worden verhoogd door het aantal botsingen tussen moleculen te verhogen. Dit kan op vele manieren, zoals het veranderen van de temperatuur, de druk of het gebruikte oplosmiddel.
V: Wat zijn overgangstoestanden?
A: Overgangstoestanden zijn tussenstadia in chemische reacties die optreden wanneer reactanten producten vormen en tijdens dit proces energie vrijkomt of wordt geabsorbeerd.
Zoek in de encyclopedie