Overgangstoestand (chemie): definitie, activeringsenergie en belang
Leer wat de overgangstoestand in de chemie is: definitie, rol van activeringsenergie, invloed op reactiemechanismen en hoe berekeningen inzicht geven.
In een chemische reactie is de overgangstoestand het punt langs het reactiepad waarop de energie maximaal is. Die maximale energie wordt de activeringsenergie genoemd. Wanneer twee of meer moleculen worden gemengd en zij elkaar raken met voldoende energie om door de overgangstoestand te gaan, zullen ze reageren en nieuwe moleculen vormen. In de overgangstoestand worden nieuwe bindingen deels gevormd terwijl oude bindingen deels verbroken zijn. In een energieprofiel of tekening wordt de overgangstoestand vaak aangeduid met het symbool van de dubbele dolk ‡.
Kernmerken van de overgangstoestand
- Maximaal energiepunt langs het reactiecoördinaat: de overgangstoestand is een eerstegraads zadelpunt op het potentiële energie-oppervlak — een maximum in de richting van het reactiepad en een minimum in de loodrechte richtingen.
- Kortstondig: doordat de energie hoog is, bestaat de overgangstoestand slechts zeer kort, typisch in de orde van femtoseconden tot picoseconden.
- Eén imaginair frequentiegetal: bij berekeningen verschijnt voor een echte overgangstoestand precies één zogenaamde imaginaire vibratiefrequentie die correspondeert met de reactierichting.
- Niet hetzelfde als tussenproduct: tussenproducten (intermediairen) bevinden zich in lokale energieminima en kunnen veel langer bestaan dan een overgangstoestand; ze zijn stabieler en kunnen soms worden geïsoleerd of waargenomen.
- Notatie: men gebruikt vaak het symbool ‡ achter de naam van het complex of het traject (bijv. A–B‡) om aan te geven dat het om de overgangstoestand gaat.
Activeringsenergie en reactiesnelheid
De hoogte van de activeringsenergie bepaalt in sterke mate hoe snel een reactie verloopt: hoe hoger de activeringsenergie, hoe minder waarschijnlijk het is dat reagerende deeltjes voldoende energie hebben om het energietopje te bereiken, en dus hoe langzamer de reactie. Twee veelgebruikte formuleringen zijn:
- Arrhenius-vergelijking: k = A · e^{−Ea/RT}, waarbij Ea de activeringsenergie is.
- Transition state (Eyring) theorie: k = (kB·T/h) · e^{−ΔG‡/RT}, waarbij ΔG‡ de vrije energie van activering is, kB de Boltzmann-constante en h de Planck-constante. Deze benadering koppelt de eigenschappen van de overgangstoestand direct aan de snelheid van de reactie.
Hammond-postulaat en structuur
Het Hammond-postulaat geeft een praktische richtlijn voor de structuur van de overgangstoestand: een overgangstoestand lijkt structureel meer op het vlak waarvan zij qua energie het dichtst ligt. Voor een exotherme stap lijkt de overgangstoestand dus meer op de reagentia, voor een endotherme stap meer op de producten. Dit helpt chemici voorspellingen te doen over welke bindingen in de overgangstoestand al sterk gevormd of verbroken zijn.
Hoe bestudeert men overgangstoestanden?
Direct waarnemen van een overgangstoestand is meestal niet mogelijk omdat deze extreem kort bestaat. Toch bestaan er verschillende experimentele en theoretische methoden om informatie te verkrijgen:
- Experimenten: kinetische metingen (temperatuurafhankelijkheid van snelheden), kinetische isotopen-effecten en ultrakorte laserspectroscopie (femtoseconde-spectroscopie) kunnen aanwijzingen geven over het bestaan en de aard van een overgangstoestand.
- Computationele chemie: methoden zoals DFT en ab initio berekeningen vinden de overgangstoestand als een zadelpunt op het potentiële energie-oppervlak. Men voert transitiebaanoptimalisaties en berekent de intrinsieke reactiecoördinaat (IRC) om het pad van reagentia via de overgangstoestand naar producten te volgen.
- Modelleren van vrije energie: door vrije-energieberekeningen kan men ΔG‡ schatten en zo reactiesnelheden voorspellen met behulp van Eyring-theorie.
Belang in katalyse en biochemie
Het begrip overgangstoestand is fundamenteel voor het ontwerpen van katalysatoren. Een katalysator verlaagt de activeringsenergie door de overgangstoestand relatief sterker te stabiliseren dan de reagentia, waardoor de reactiesnelheid toeneemt. Enzymen zijn gespecialiseerde katalysatoren die vaak door specifieke interacties de overgangstoestand binden en daardoor enorme snelheidsverhogingen geven. Dit principe wordt ook gebruikt bij het ontwerp van zogenaamde overgangstoestand-analoga: moleculen die de geometrie van de overgangstoestand nabootsen en zo sterk aan enzymen binden als remmers.
Praktische voorbeelden
- SN2-reactie: de overgangstoestand is een pentacoördinerend, “half gevormd/half gebroken” complex bij het koolstofcentrum, met gelijktijdig inkomende en vertrekkende groepen.
- Protonoverdracht: vaak korte, strak gecoördineerde structuren waarin het proton zich in het midden tussen donor en acceptor bevindt in de overgangstoestand.
- Pericyclische reacties: concertante reacties waarbij de overgangstoestand vaak een cyclisch, delokaliseerd elektronentraject omvat.
Samenvatting
De overgangstoestand is het kritieke, energie-arme padpunt dat bepaalt hoe een reactie optreedt: het is het energiemaximum langs het reactiepad, bezit één imaginair vibratiefrequentie en is zeer kortstondig. Kennis van de overgangstoestand en de bijbehorende activeringsenergie is essentieel voor het begrijpen en sturen van reactiesnelheden, voor het ontwerpen van katalysatoren en voor inzicht in biochemische processen zoals enzymwerking. Hoewel direct detecteren lastig is, bieden moderne experimentele technieken en rekenmethoden een steeds beter beeld van deze centrale schakel in chemische reacties.
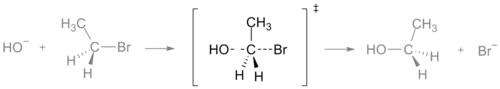
De overgangstoestand van een SN2-reactie
Vragen en antwoorden
V: Wat is de overgangstoestand in een chemische reactie?
A: De overgangstoestand is het punt waar de energie in een chemische reactie maximaal is.
V: Wat is de activeringsenergie in een chemische reactie?
A: De energie die nodig is om een reactie te laten plaatsvinden wordt de activeringsenergie genoemd.
V: Wat gebeurt er als twee of meer moleculen in een chemische reactie gemengd worden?
A: Als twee of meer moleculen gemengd worden, zullen ze elkaar raken. Als ze elkaar met genoeg energie raken om door de overgangstoestand te gaan, zullen ze reageren en nieuwe moleculen vormen.
V: Waarvoor wordt het dubbele dolk (‡) symbool gebruikt in een grafiek of tekening van een chemische reactie?
A: Het dubbele dolk (‡) symbool wordt gebruikt om de overgangstoestand in een grafiek of tekening van een chemische reactie aan te geven.
V: Waarom is het moeilijk om de overgangstoestand in een chemische reactie te bestuderen?
Antwoord: Het is heel moeilijk om de overgangstoestand in een chemische reactie te bestuderen, omdat die zo energierijk is dat de moleculen maar heel kort in die vorm blijven, meestal femtoseconden.
V: Wat is een tussenproduct in een chemische reactie?
A: Een tussenproduct is een molecuul dat zich op een minimaal energiepunt in een chemische reactie bevindt en zeer lang kan blijven bestaan.
V: Waarom is het bestuderen van overgangstoestanden belangrijk bij het begrijpen van reactiemechanismen?
A: Het bestuderen van overgangstoestanden is belangrijk bij het begrijpen van reactiemechanismen omdat het helpt om te bepalen hoe een reactie verloopt en hoe deze gecontroleerd of gemanipuleerd kan worden.
Zoek in de encyclopedie