Enolen en enolaten: definitie, tautomeren en kinetische vs thermodynamische vormen
Leer enolen en enolaten: definitie, tautomeren, aldolreactie en hoe je kinetische vs thermodynamische enolaten met bases en temperatuur stuurt.
Een enolaat is een alkeen met een OH-groep aan een uiteinde van de dubbele binding. Het wordt een enolaat genoemd als het proton op het zuurstofatoom is weggenomen: er ontstaat een geladen zuurstofatoom en een geconjugeerde dubbele binding tussen de α‑ en β‑koolstof. Door resonantie kan die lading verdeeld worden over zuurstof en α‑koolstof, waardoor enolaten zeer nuttige nucleofielen zijn in organische synthese.
Enolen zijn tautomeren van ketonen of aldehyden. Tautomeren zijn moleculen die alleen verschillen in de plaats van een waterstofatoom; bij keton–enol tautomerisatie verhuist een α‑proton naar het zuurstof, waardoor de C=O verandert in een C=C–OH. Enolen kunnen heel gemakkelijk uit ketonen of aldehyden worden gemaakt met behulp van een base, maar in de meeste gevallen is de carbonylvorm (C=O) thermodynamisch gunstiger omdat de C=O‑binding sterker is dan de C=C‑binding. Desondanks zijn enolen en vooral hun geconjugeerde enolaten reactief en voeren ze veel nuttige reacties uit; het beste voorbeeld is de aldolreactie, maar ook alkylaties, Michael‑addities en Claisen‑type reacties zijn belangrijk.
Vorming van enolaten: kinetische versus thermodynamische enolaten
Bij ketonen met verschillende α‑posities kunnen enolaten aan twee kanten worden gevormd. Het is belangrijk te kunnen kiezen aan welke kant gereageerd moet worden. De kant met minder substituenten (minder gehinderd) is doorgaans het gemakkelijkst te deprotoneren onder snelle, kinetische condities: dit geeft het kinetische enolaat. Het kinetische enolaat wordt vaak gevormd met een sterke, volumineuze (sterisch gehinderde) base bij lage temperatuur (bijv. −78 °C) en in aanwezigheid van niet‑protische, aprotische oplosmiddelen. Veelgebruikte voorbeelden zijn LDA (lithiumdiisopropylamide) of LiTMP; door snelle en volledige deprotonering en lage temperatuur wordt het systeem niet in staat gesteld te equilibreren.
De andere kant, met meer substituenten (meer gestabiliseerd door alkylgroepen of andere elektron‑donor substituenten), leidt vaak tot het thermodynamische enolaat. Dit enolaat is energetisch stabieler en wordt bereikt onder condities die equilibratie toestaan: zwakkere basen (bijv. alkoxiden zoals NaOEt) of verhoging van de temperatuur en langere reactietijden. Bij deze condities kan het systeem van enolaatvormen onderling wisselen en uiteindelijk de meest stabiele (thermodynamische) isomeer domineren.
Praktische regels om te sturen welke enolaat ontstaat
- Wil je het kinetische enolaat: gebruik een stoichiometrie dicht bij 1 eq van een sterke, niet‑nucleofiele, volumineuze base (bijv. LDA), koude temperaturen (−78 °C) en minimale reactietijd.
- Wil je het thermodynamische enolaat: gebruik een zwakkere base (alkoxide), hogere temperatuur en laat het systeem langer reageren zodat equilibratie plaatsvindt; of gebruik een overmaat base en warmte.
- De mate van substitutie, stabilisatie door conjugatie of elektronenzuigende groepen, en de aard van het metaal (Li, Na, K) en oplosmiddel (THF, ether, DMSO) beïnvloeden regio‑ en stereoselectiviteit.
Structuur, reactiviteit en toepassingen
Enolaten zijn ambidente nucleofielen: ze kunnen reageren via de zuurstof (O‑alkylatie) of via de α‑koolstof (C‑alkylatie). Welke plaats reageert hangt af van de aard van het elektrofiel, het metaalion en de oplosmiddelomstandigheden. Carbonalkylaties (C‑alkylatie) zijn meestal gewenst in synthese (bijv. voor vorming van C–C bindingen), maar selectiviteit vereist vaak zorgvuldige keus van tegenion en reactiecondities.
Enolatevorming en -reacties komen veel voor in:
- Aldolreacties en intramoleculaire condensaties
- Alkylaties (SN2) van α‑positie
- Michael‑addities aan α,β‑onverzadigde carbonylverbindingen
- Claisen‑condensaties en Robinson‑annulaties
Factoren die regio‑ en stereo‑selectiviteit bepalen
- Base‑sterkte en bulk: volumineuze, sterke basen geven kinetische enolaten; zwakkere basen geven thermodynamische producten.
- Metaalion‑effecten: lithium‑enolaten vormen vaak geaggregeerde structuren en kunnen door chelatie andere geometrieën (E/Z) bevoordelen; natrium‑ en kaliumzouten gedragen zich anders en geven soms meer O‑reactiviteit.
- Oplosmiddel: polair aprotisch (THF) stabiliseert bepaalde aggregaten; coördinatie aan contrametaal verandert reactiviteit.
- Substituenten op de keton: elektronenzuigende groepen stabiliseren enolaten en verlagen de pKa van α‑H, waardoor ze makkelijker gedeprotoneerd worden.
- Temperatuur en tijd: koude, korte condities vorderen kinetische producten; warmte en langer laten reageren geeft thermodynamische controle.
Enolaten in de praktijk: voorbeelden en aanvullende technieken
Veel syntheses gebruiken afgeleiden van enolaten voor betere beheersing van reactiviteit, bijvoorbeeld silyl-enol ethers (TMS‑enolen) die gevormd kunnen worden uit enolaten of rechtstreeks via silylatie; deze laten gemakkelijke en selectieve functionalisatie toe. Voor alkylatie zoekt men vaak naar C‑alkylatie; het vermijden van O‑alkylatie vraagt aandacht voor elektrofiel en metaal. De keuze voor LDA (conjugaatzuur pKa ≈ 36 voor diisopropylamine) versus een alkoxide base (conjugaatzuur pKa ≈ 16 voor ethanol) illustreert waarom LDA sterk genoeg is om snel α‑H te verwijderen terwijl alkoxide condities meer equilibratie toelaten.
Samengevat: enolen en enolaten zijn centrale tussenproducten in de organische chemie. Begrip van tautomerisatie, basen, temperatuur, metaal‑contrametaal en oplosmiddel maakt het mogelijk selectief het kinetische of het thermodynamische enolaat te vormen en zo gecontroleerd C–C of C–X bindingen te maken in synthese.
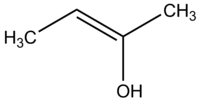
Een enol
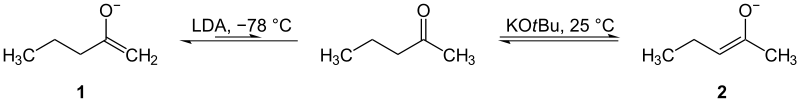
Kinetische (1) en thermodynamische (2) enolaten
Vragen en antwoorden
V: Wat is een enol?
A: Een enol is een alkeen met een OH-groep aan een uiteinde van de dubbele binding.
V: Wat is een enolaat?
A: Een enolaat is een enol waarbij het proton op het zuurstofatoom is verwijderd.
V: Wat zijn tautomeren?
A: Tautomeren zijn moleculen die alleen verschillen in de positie van een waterstofatoom.
V: Hoe kunnen enolen worden gemaakt uit ketonen of aldehyden?
A: Enolen kunnen gemakkelijk worden gemaakt uit ketonen of aldehyden met behulp van een base.
V: Waarom zijn enolen instabiel?
A: Enolen zijn instabiel omdat de C=O-binding sterker is dan de C=C-binding.
V: Wat is de aldolreactie?
A: De aldolreactie is een interessante reactie die met enolen kan worden uitgevoerd.
V: Hoe kan de kant van een enol met minder substituenten geschikt worden gemaakt voor de reactie?
A: De kant van een enol met minder substituenten, het zogenaamde kinetisch enolaat, kan bij lage temperatuur worden gemaakt met een volumineuze base voor de reactie.
Zoek in de encyclopedie