Pi-binding
In de chemie zijn pi-bindingen (π-bindingen) covalente chemische bindingen waarbij het orbitale pad van het ene elektron kruist (overlapt) met het pad van een ander elektron. De elektronen hebben een kwabvormig figuur van acht banen (zie afbeelding). Er zijn twee overlappingsgebieden omdat de banen elkaar op beide lobben overlappen. Slechts één van de knooppuntvlakken van de baan gaat door beide betrokken kernen.
De Griekse letter π in hun naam verwijst naar p orbitalen. De orbitale symmetrie van de pi-binding ziet er hetzelfde uit als die van de p-binding als je naar beneden kijkt. P-banen hebben meestal een dergelijke binding. D-banen worden ook verondersteld pi-binding te gebruiken, maar dit is niet noodzakelijkerwijs wat er in de werkelijkheid gebeurt. Het idee van binding van d-banen past in de theorie van de hypervalentie.
Pi-bindingen zijn meestal zwakker dan sigma-bindingen. Quantummechanica zegt dat dit komt omdat de orbitale paden parallel lopen zodat er veel minder overlap is tussen de p-orbitalen.
Pi-bindingen ontstaan wanneer twee atoombanen met elkaar in contact komen door twee overlappende gebieden. Pi-bindingen zijn meer gespreide bindingen dan de sigma-bindingen. Elektronen in pi-bindingen worden soms pi elektronen genoemd. Moleculaire fragmenten die met elkaar verbonden zijn door een pi-binding kunnen niet om die binding heen draaien zonder de pi-binding te verbreken. De rotatie vernietigt de parallelle paden van de twee p-banen.
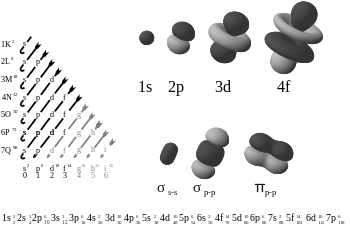
Elektronen atomaire en moleculaire orbitalen, met rechtsonder op de foto een pi-binding.

Twee p-orbitalen die een π-bond vormen.
Meervoudige banden
Atomen die met elkaar verbonden zijn door een dubbele binding hebben een sigma- en een pi-binding. Als ze verbonden zijn door een drievoudige binding hebben ze één sigma-obligatie en twee pi-bindingen.
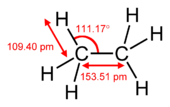
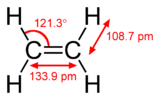
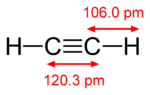
Een pi-binding is zwakker dan een sigma-binding, maar de combinatie van pi en sigma-binding is sterker dan beide bindingen op zich. De extra sterkte van een meervoudige binding ten opzichte van een enkele (sigma) binding wordt op vele manieren getoond. De meest voor de hand liggende is een samentrekking in de lengte van de binding. Bijvoorbeeld in de organische chemie zijn koolstof-koolstof bindingslengtes in ethaan (154 pm), in ethyleen (134 pm) en in acetyleen (120 pm). Meer bindingen maken de totale binding korter en sterker. De elektronische configuratie is gebaseerd op S,P,D,en f-blok. S heeft 2 elektronen P heeft 6 elektronen D heeft 10 elektronen F heeft 14 elektronen
|
|
|
|
| ethaan | acetyleen |
Bijzondere gevallen
Pi-bindingen zijn niet noodzakelijkerwijs verbonden met een paar atomen die ook sigma-gebonden zijn.
In bepaalde metaalcomplexen vormen pi-wisselwerkingen tussen een metaalatoom en alkyne- en alkeenpi-antibindingen pi-bindingen.
In sommige gevallen van meerdere bindingen tussen twee atomen is er helemaal geen sigma-binding, alleen pi-bindingen. Voorbeelden hiervan zijn diijzerhexacarbonyl (Fe2(CO)6), dicarbon (C2) en het boraan B2H2. In deze verbindingen heeft de centrale verbinding alleen pi-bindingen. Om een zo groot mogelijke orbitale overlap te krijgen zijn de bindingsafstanden veel korter dan verwacht.
Vragen en antwoorden
V: Wat is een pi binding in de scheikunde?
A: Een pi binding is een covalente chemische binding waarbij het baanpad van een elektron kruist met het pad van een ander elektron, waardoor twee overlappende gebieden ontstaan omdat de banen elkaar op beide lobben overlappen.
V: Wat is de Griekse letter waarnaar in hun naam wordt verwezen?
A: De Griekse letter in hun naam is π en verwijst naar p-banen.
V: Wat is de orbitale symmetrie van de pi-binding?
A: De orbitaalsymmetrie van de pibinding ziet er langs de as van de binding hetzelfde uit als de p-baan, omdat p-banen meestal dit soort bindingen hebben.
V: Waarom zijn pi-bindingen meestal zwakker dan sigma-bindingen?
A: Pi-bindingen zijn meestal zwakker dan sigma-bindingen omdat volgens de kwantummechanica de banen van de orbitalen parallel zijn, dus is er veel minder overlap tussen de p-orbitalen.
V: Wanneer komen pi-bindingen voor?
A: Pi-bindingen ontstaan wanneer twee atomaire orbitalen met elkaar in contact komen door twee overlappende gebieden.
V: Wat zijn pi-bindingen?
A: Pi-bindingen zijn meer gespreide bindingen dan sigma bindingen.
V: Kunnen moleculaire fragmenten die verbonden zijn door een pi-binding om die binding draaien zonder de pi-binding te verbreken?
A: Nee, moleculaire fragmenten die verbonden zijn door een pibinding kunnen niet om die binding draaien zonder de pibinding te verbreken, omdat de draaiing de parallelle paden van de twee p-banen vernietigt.
Zoek in de encyclopedie