Sulfoxide
Een sulfoxide is een molecuul waarin een zwavelatoom gebonden is aan twee koolwaterstoffen en één zuurstofatoom. Het ontstaat bij de oxidatie van thioethers, zonder helemaal naar het sulfon te gaan. Zoals veel moleculen die zwavel bevatten, kan sulfoxide soms erg stinken.
Sulfoxiden kunnen worden geschreven met de algemene formule R-S(=O)-R'. Zwavel heeft een dubbele binding met de zuurstof, en een enkele binding met de koolwaterstoffen. Er blijft dus een lone pair over op het atoom. Dit betekent dat de vorm op dat atoom tetrahedraal is. Het betekent ook dat de zwavel een chiraal centrum kan zijn. Sulfoxiden worden gebruikt als goede liganden voor overgangsmetalen.
Een belangrijke molecule van dit type is dimethylsulfoxide. Het wordt ook wel DMSO genoemd. Het wordt gebruikt als oplosmiddel voor veel reacties, vooral in de biochemie.
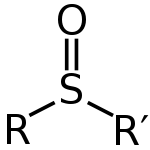
Algemene structuur van een sulfoxide
Vragen en antwoorden
V: Wat is een sulfoxide?
A: Een sulfoxide is een molecule waarin een zwavelatoom gebonden is aan twee koolstoffen en een zuurstofatoom.
V: Waar komt sulfoxide vandaan?
A: Sulfoxide ontstaat door thioethers te oxideren zonder helemaal naar het sulfon te gaan.
V: Wat is de algemene formule voor sulfoxiden?
A: De algemene formule voor sulfoxiden is R-S(=O)-R'.
V: Wat is de vorm van het atoom in sulfoxiden?
A: De vorm van het atoom in sulfoxiden is tetraëdervormig.
V: Kan zwavel een chiraal centrum in sulfoxiden zijn?
A: Ja, zwavel in sulfoxiden kan een chiraal centrum zijn.
V: Wat is dimethylsulfoxide en wat is het nut ervan?
A: Dimethylsulfoxide, ook bekend als DMSO, is een belangrijke sulfoxidemolecule en wordt gebruikt als oplosmiddel voor veel reacties, vooral in de biochemie.
V: Waarom worden sulfoxiden gebruikt als goede liganden voor overgangsmetalen?
A: Sulfoxiden worden gebruikt als goede liganden voor overgangsmetalen omdat ze door het elektronenpaar op het zwavelatoom coördineren met metaalionen.
Zoek in de encyclopedie