Koolstof | zeer belangrijk chemisch element
Koolstof is een zeer belangrijk chemisch element, met als chemisch symbool C. Al het bekende leven op aarde heeft het nodig. Koolstof heeft atoommassa 12 en atoomnummer 6. Het is een niet-metaal, wat betekent dat het geen metaal is.
Wanneer ijzer wordt gelegeerd met koolstof, ontstaat hard staal. Koolstof in de vorm van steenkool is een belangrijke brandstof.
Chemie van koolstof
Een hele vorm van chemie, organische chemie genaamd, gaat over koolstof en zijn verbindingen. Koolstof maakt vele soorten verbindingen. Koolwaterstoffen zijn moleculen met koolstof en waterstof. Methaan, propaan en vele andere brandstoffen zijn koolwaterstoffen. Veel van de stoffen die mensen dagelijks gebruiken zijn organische verbindingen.
Koolstof, waterstof, stikstof, zuurstof en enkele andere elementen zoals zwavel en fosfor vormen samen het meeste leven op aarde (zie Lijst van biologisch belangrijke elementen). Koolstof vormt een zeer groot aantal organische verbindingen omdat het sterke bindingen kan vormen met zichzelf en met andere elementen. Vanwege de hoeveelheid koolstof die levende dingen hebben, worden alle organische dingen beschouwd als "op koolstof gebaseerd".
Elk koolstofatoom vormt gewoonlijk vier chemische bindingen, die sterke verbindingen vormen met andere atomen om moleculen te vormen. Het soort binding dat koolstof maakt, wordt een covalente binding genoemd. Door deze bindingen kan koolstof vele soorten kleine en grote moleculen vormen. Een molecuul methaan is het kleinst; het heeft vier waterstofatomen gebonden aan koolstof. De bindingen kunnen dubbele bindingen zijn, wat betekent dat twee bindingen worden gevormd tussen koolstof en een ander atoom om een sterkere verbinding te maken. Koolstofdioxide heeft bijvoorbeeld twee zuurstofatomen, die elk een dubbele binding hebben met koolstof. Koolstof kan zelfs drie bindingen vormen met een ander atoom, een zogenaamde drievoudige binding. In het gas acetyleen bijvoorbeeld vormt koolstof een drievoudige binding met een ander koolstofatoom.
Door binding met andere koolstofatomen kan koolstof lange ketenvormige moleculen vormen, polymeren genaamd, zoals kunststoffen en eiwitten. Atomen van andere elementen kunnen deel uitmaken van de lange polymeerketens, vaak stikstof of zuurstof.
Zuivere koolstof vormt diamant door binding met vier andere koolstofatomen in een driedimensionaal kristal. Het vormt grafiet door binding met drie andere koolstofatomen tot dunne platte lagen.
Etymologie
De naam koolstof komt van het Latijnse carbo, dat houtskool betekent. In veel vreemde talen zijn de woorden voor koolstof, steenkool en houtskool synoniemen.
Soorten koolstof
Koolstof komt in de natuur voor in drie vormen die allotropen worden genoemd: diamant, grafiet en fullerenen. Grafiet, met klei, zit in potloden. Het is zeer zacht. De koolstofatomen erin maken ringen, die op elkaar liggen en heel gemakkelijk schuiven. Diamant is het hardste natuurlijke mineraal. Fullerenen zijn een "voetbalvorm" van koolstof. Ze zijn vooral interessant voor de wetenschap. Een speciale, door de mens gemaakte, buisvormige allotroop van koolstof is de koolstofnanobuis. Koolstofnanobuizen zijn zeer hard, dus ze zouden kunnen worden gebruikt in pantser. Nanobuizen kunnen nuttig zijn in de nanotechnologie.
Er zijn 10 miljoen bekende koolstofverbindingen.
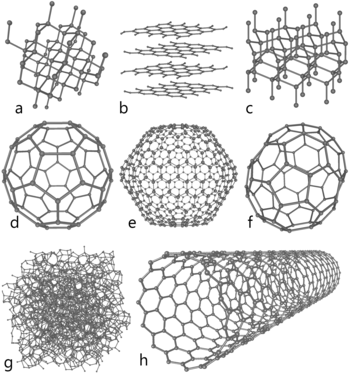
Enkele vormen van koolstof: a) diamant; b) grafiet; c) lonsdaleiet; d-f) fullerenen (C60, C540, C70); g) amorfe koolstof; h) koolstofnanobuis.
Radiokoolstofdatering
Een radioactieve isotoop van koolstof, koolstof-14, kan worden gebruikt om na te gaan hoe oud sommige voorwerpen zijn of wanneer iets is gestorven. Zolang iets zich op het aardoppervlak bevindt en koolstof opneemt, blijft de hoeveelheid koolstof-14 gelijk. Wanneer een voorwerp geen koolstof meer opneemt, daalt de hoeveelheid koolstof-14. Omdat de halveringstijd (hoe lang het duurt voordat de helft van een radioactieve isotoop is verdwenen) van koolstof-14 5730 jaar is, kunnen wetenschappers aan de hand van de hoeveelheid koolstof-14 die nog over is, zien hoe oud een voorwerp is.
Waarbij koolstof is
Koolstof komt op veel plaatsen in het heelal voor. Het werd voor het eerst gemaakt in oude sterren. Koolstof is het vierde meest voorkomende element in de zon. De atmosfeer van Venus en Mars bestaat voornamelijk uit koolstofdioxide.
Koolstof is belangrijk voor het menselijk lichaam en andere levende wezens, en het is het tweede meest voorkomende element in het menselijk lichaam, met 23% van het totale lichaamsgewicht. Het is ook een belangrijk onderdeel van veel biologische moleculen (moleculen die in het leven worden gebruikt).
De meeste koolstof op aarde is steenkool. Grafiet komt in veel (meestal woestijnachtige) gebieden voor, waaronder Sri Lanka, Madagaskar en Rusland. Diamanten zijn zeldzaam en worden voornamelijk in Afrika gevonden. Koolstof zit ook in sommige meteorieten.
Gerelateerde pagina's
- Lijst van gemeenschappelijke elementen
- Koolstofcyclus
Vragen en antwoorden
V: Wat is het chemische symbool voor koolstof?
A: Het chemische symbool voor koolstof is C.
V: Wat is de atoommassa van koolstof?
A: De atoommassa van koolstof is 12.
V: Wat is het atoomnummer van koolstof?
A: Het atoomnummer van koolstof is 6.
V: Is koolstof een metaal of een niet-metaal?
A: Koolstof is een niet-metaal, wat betekent dat het geen metaal is.
V: Hoe vormen ijzer en koolstof samen hard staal wanneer ze worden gelegeerd?
A: Wanneer ijzer en koolstof samen worden gelegeerd, vormen zij hard staal.
V: Welk type brandstof kan worden gemaakt van steenkool, dat veel koolstof bevat?
A: Steenkool, dat veel koolstof bevat, kan worden gebruikt om een belangrijke brandstofbron te maken.
Zoek in de encyclopedie