Thiol (R–SH): definitie, eigenschappen, geur en toepassingen
Thiol (R–SH): heldere definitie, eigenschappen, sterke geur en toepassingen — van aardgasadditie tot cysteïne in eiwitten. Ontdek oxidatie, zuurtegraad en reactiviteit.
Een thiol is een molecuul dat een R-SH groep heeft. Thiolen zijn als alcoholen waarbij een zuurstofatoom is vervangen door een zwavelatoom. Ze hebben vaak een zeer sterke en slechte geur. Thiolen worden aan aardgas toegevoegd zodat mensen het kunnen ruiken. Methaan heeft namelijk geen geur, maar kan zeer gemakkelijk ontploffen.
Thiolen zijn zeer gemakkelijk te oxideren. Zij zijn ook vrij zuur, meer dan alcoholen. Wanneer het proton wordt weggenomen door een base, kan het thiol een nucleofiel worden. Het kan reacties uitvoeren zoals nucleofiele substitutie.
Een van de natuurlijke aminozuren, cysteïne, heeft een thiol in zijn structuur.
Structuur, naamgeving en voorbeelden
Een thiol heeft de algemene formule R–SH, waarbij R een alkyl- of arylgroep kan zijn. In de systematische naamgeving eindigen de namen van eenvoudige thiolen op «-thiol» (bijv. methanethiol, ethanethiol). In oudere literatuur worden thiolen ook wel mercaptanen genoemd — vooral in industriële toepassingen zoals het toevoegen van geurstoffen aan aardgas.
Fysische eigenschappen en geur
Thiolen hebben over het algemeen vergelijkbare fysische eigenschappen als alcoholen, maar met enkele verschillen door het grotere en minder elektronegatieve zwavelatoom. Ze hebben vaak lagere kookpunten dan vergelijkbare alcoholen en zijn meestal matig polair. Veel lage-molecuulgewicht thiolen hebben een zeer onaangename, doordringende geur (bv. rotte eieren, knoflook, of stinkdier-achtige geuren). De geurdetectiedrempel is extreem laag: mensen kunnen thiolen vaak al bij zeer lage concentraties (ppb-niveau) ruiken, waardoor ze geschikt zijn als detectieadditieven voor gaslekken.
Chemische eigenschappen en reactiviteit
- Zuurdeskundigheid: Thiolen zijn zuurder dan alcoholen. Typische pKa-waarden voor eenvoudige alifatische thiolen liggen rond 10–11, terwijl aromatische thiolen (thiophenolen) aanzienlijk zuurder kunnen zijn (pKa ~6–7).
- Vorming van thiolaten: Na deprotonering ontstaat het thiolaat (R–S−), een goede, zogenaamd «zachte» nucleofiel en coördinatieligand. Thiolaten reageren gemakkelijk in nucleofiele substituties en additiereacties en binden sterk aan bepaalde metalen.
- Oxidatie: Thiolen oxideren gemakkelijk tot disulfiden (R–S–S–R) bij milde oxidatie. Disulfidevorming is belangrijk in de chemie en biochemie; bij sterkere oxidatie kunnen sulfoxiden, sulfones of uiteindelijk sulfonzuren ontstaan.
- Redoxchemie in biologie: Oxidatie en reductie van thiolen/thiolaten speelt een centrale rol in cellulaire signaalprocessen en redoxbalans.
Rol in de biochemie
Cysteïne is een aminozuur met een thiolgroep in zijn zijketen. Twee cysteïneresten kunnen onder oxidatieve omstandigheden een disulfidebrug vormen (cystine), die belangrijke structurele en functionele rollen vervult in eiwitten door vouwing en stabilisatie van tertiaire en quaternaire structuren. De reactieve thiolgroep van cysteïne speelt ook een rol in enzymmechanismen en in de bescherming tegen oxidatieve stress (bijv. glutathion is een klein thiolhoudend peptidesysteem dat essentieel is voor cellulaire bescherming).
Toepassingen
- Geurstoffen/veiligheid: Lage concentraties thiolen (mercaptanen) worden toegevoegd aan aardgas om lekkages te detecteren.
- Organische synthese: Thiolen en thiolaten worden gebruikt als nucleofielen, beschermingsgroepen en in „click”-reacties zoals thiol–ene polymerisaties.
- Polymeerchemie en vulkanisatie: Zwavelverbindingen en thiolchemie spelen een rol bij het crosslinken en modificeren van polymeren.
- Coördinatiechemie en metallurgie: Thiolaten binden sterk aan zachte metalen (bv. Hg, Pb, Cu) en worden gebruikt in liganden en extractiemethoden; dimercaprol (2,3-dimercapto-1-propaanol) wordt medisch gebruikt als chelaatvormer bij sommige metalenvergiftigingen.
Synthese van thiolen
Veelgebruikte methoden om thiolen te bereiden zijn nucleofiele substitutie van een alkylhalide met sulfide- of thiolaationen (bijv. behandeling met NaSH), reductie van disulfiden, of via thiokarbamaat-/thiourea-route voor de vorming van primair thiolen. De precieze keuze van methode hangt af van de gewenste structuur en zuiverheid.
Veiligheid en milieu
Thiolen zijn vaak licht ontvlambaar en hun sterke geur kan al bij zeer lage concentraties hinderlijk of gezondheidsrelevant zijn. Sommige zwavelhoudende verbindingen zijn toxisch of irriterend. Bij omgang met thiolen is goede ventilatie en het vermijden van ontstekingsbronnen belangrijk. In milieucontext kunnen zwavelverbindingen bijdragen aan onaangename geuren en in sommige gevallen corrosie van apparatuur bevorderen.
Samengevat: thiolen zijn zwavelanalogen van alcoholen met karakteristieke chemische en sensorische eigenschappen. Hun neiging tot oxidatie, hun rol als goede nucleofielen/liganden en hun aanwezigheid in belangrijke biologische moleculen zoals cysteïne maken ze zowel praktisch nuttig als biologisch essentieel.
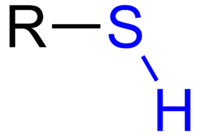
Algemene formule voor een thiol
Vragen en antwoorden
V: Wat is een thiol?
A: Een thiol is een molecuul met een R-SH groep.
V: Hoe lijken thiolen op alcoholen?
A: Thiolen lijken op alcoholen waarbij een zuurstofatoom is vervangen door een zwavelatoom.
V: Waarom worden thiolen aan aardgas toegevoegd?
A: Thiolen worden aan aardgas toegevoegd zodat mensen het kunnen ruiken omdat methaan, dat geurloos is, heel gemakkelijk kan ontploffen.
V: Wat is de sterke en slechte geur die met thiolen geassocieerd wordt?
A: Thiolen hebben vaak een zeer sterke en slechte geur.
V: Wat gebeurt er als een proton door een base van een thiol wordt afgenomen?
A: Als het proton door een base wordt weggenomen, kan het thiol een nucleofiel worden.
V: Wat voor zuur zijn thiolen?
A: Thiolen zijn behoorlijk zuur, meer dan alcoholen.
V: Heeft één van de natuurlijke aminozuren een thiol in zijn structuur?
A: Ja, één van de natuurlijke aminozuren, cysteïne, heeft een thiol in zijn structuur.
Zoek in de encyclopedie