Wat is een elektrofiel (Lewiszuur)? Definitie, eigenschappen en voorbeelden
Wat is een elektrofiel (Lewiszuur)? Duidelijke definitie, eigenschappen en voorbeelden (HCl, carbonyls, oxidatiemiddelen) plus uitleg van reacties met nucleofielen.
In de chemie is een elektrofiel een molecuul of atoom dat graag elektronen van een ander molecuul of atoom overneemt. Veel elektrofielen hebben een positieve lading. Ze worden ook wel Lewiszuren genoemd. Voorbeelden van elektrofielen zijn moleculen waarvan de atomen een groot verschil in elektronegativiteit hebben, zoals HCl of een carbonyl, of ook oxidatiemiddelen.
Elektrofielen worden aangevallen door een nucleofiel, dat is het tegenovergestelde soort molecuul. Dit gebeurt bijvoorbeeld in additiereacties.
Wat bedoelen we precies met elektrofiel (Lewiszuur)?
Electrofiel is een reactierol: het is een soort reagentia dat een elektronenpaar accepteert van een ander deeltje (het nucleofiel). In die zin valt een elektrofiel samen met het begrip Lewiszuur, dat chemisch gedefinieerd wordt als een elektronpaaracceptor. Elektrofielen kunnen positief geladen zijn (bijv. H+, carbocat-ionen) of neutraal maar elektronarm met een lege orbitaal (bijv. BF3, AlCl3).
Belangrijke eigenschappen van elektrofielen
- Elektrontekort of lege orbitaal: elektrofielen hebben een plaats waar een elektronpaar kan binden (lage LUMO of lege orbitalen).
- Positieve lading of partiële positieve lading: veel elektrofielen dragen een volledige of partiële positieve lading door inductieve of mesomere effecten.
- Polariseerbaarheid: zachte elektrofielen zijn goed polariseerbaar en reageren anders dan harde, onbuigzame elektrofielen (HSAB-principe).
- Reactierol: in een reactie wordt het elektrofiel door een nucleofiel aangevallen; de nucleofiel levert het elektronenpaar.
- Beïnvloedende factoren: elektronegativiteit van omliggende atomen, resonantie, inductieve effecten, en sterische hindering verhogen of verlagen de kracht van een elektrofiel.
Veelvoorkomende voorbeelden
- Protonen (H+) — eenvoudig maar zeer reactief elektrofiel.
- Carbocat-ionen (R–C+–R') — ontstaan vaak als tussenstappen bij additie en substitutie.
- Geactiveerde halogenen en haloniumionen (bijv. Br+, Cl+) — betrokken bij elektrofiele addities aan alkenen.
- Carbonylcarbonen (C=O) — het koolstofatoom is elektropositief door het zuurstof en wordt vaak door nucleofielen aangevallen (bijv. nucleofiele additie aan aldehyden/ketonen).
- Nitroniumion (NO2+) — klassiek elektrofiel voor nitrering van aromaten (elektrofiele aromatische substitutie).
- Lewiszuren zoals BF3, AlCl3, FeCl3, SO3 — vaak gebruikte katalysatoren of reagentia die als elektrofielen optreden.
- Oxidatiemiddelen — sommige fungeren als elektrofielen doordat ze elektronen opnemen.
Voorbeelden van reacties waarin elektrofielen optreden
- Elektrofiele additie aan alkenen: een elektrofiel (bijv. H+ of Br+) valt de dubbele binding aan, waardoor een carbokation ontstaat dat vervolgens een nucleofiel opvangt.
- Elektrofiele aromatische substitutie (EAS): benzene en derivaten worden aangevallen door sterke elektrofielen zoals NO2+ of SO3, met vorming van een σ-complex gevolgd door deprotonering.
- Nucleofiele additie aan carbonylverbindingen: het elektrofiele koolstofatoom van een carbonylgroep wordt aangevallen door nucleofielen (bijv. hydride, alkoxide, amines).
- Acylaties en Friedel–Crafts-reacties: acyliumionen of geactivatede halogenideractieve complexen (met AlCl3) functioneren als elektrofielen.
Hard en zacht elektrofiel (HSAB)
Het HSAB-principe (Hard and Soft Acids and Bases) helpt voorspellen welke combinatie van elektrofiel en nucleofiel gunstig is. Harde elektrofielen zijn klein, weinig polariseerbaar en hebben een hoge ladingsdichtheid (bijv. H+, Al3+). Zachte elektrofielen zijn groter, meer polariseerbaar en reageren bij voorkeur met zachte nucleofielen (bijv. carbocat‑ionen, I+). Matchende hard–hard of soft–soft paren zijn doorgaans stabieler en reactiever tegenover elkaar.
Hoe beoordeel je elektrofielheid? (praktisch)
- Elektrische lading en partiële lading: positief geladen deeltjes of atomen met partiële positieve lading zijn meestal betere elektrofielen.
- Lege orbitalen / LUMO-energie: lagere LUMO-energie betekent dat het deeltje gemakkelijker elektronen accepteert.
- Inductieve en mesomere effecten: elektronen‑onttrekkende substituenten maken een centrum elektrofilekrachtiger.
- Computationale grootheden: de elektrofielheidsindex (ω) uit DFT-berekeningen wordt soms gebruikt om sterkte te kwantificeren.
Samenvatting
Een elektrofiel is een elektronpaaracceptor (Lewiszuur) die een nucleofiel aantrekt en een nieuwe binding vormt. Ze kunnen zowel positief geladen als neutraal met lege orbitalen zijn. Begrippen als elektronegativiteit, resonantie, HSAB, en LUMO-energie helpen verklaren waarom sommige deeltjes sterker elektrofiel zijn dan andere. Bekende voorbeelden zijn H+, carbocat‑ionen, carbonylkoolstofatomen en Lewiszuren zoals BF3 en AlCl3. In veel organische reacties — addities, substituties en katalytische processen — is de rol van het elektrofiel cruciaal voor het verloop en de uitkomst van de reactie.
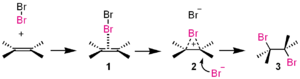
In deze additiereactie is broom (Br2) het elektrofile
Vragen en antwoorden
V: Wat is een elektrofiel?
A: Een elektrofiel is een molecuul of atoom dat graag elektronen van een ander molecuul of atoom overneemt.
V: Waarom worden elektrofielen ook Lewiszuren genoemd?
A: Elektrofielen worden ook Lewiszuren genoemd omdat ze elektronenparen van andere moleculen kunnen accepteren.
Vraag: Wat zijn enkele voorbeelden van elektrofielen?
A: Enkele voorbeelden van elektrofielen zijn moleculen waarvan de atomen een groot verschil in elektronegativiteit hebben, zoals HCl of een carbonyl, of ook oxiderende stoffen.
V: Hoe reageren nucleofielen met elektrofielen?
A: Nucleofielen reageren met elektrofielen door ze aan te vallen.
V: Wat is een nucleofiel?
A: Een nucleofiel is het tegenovergestelde soort molecuul van een elektrofiel. Het is een molecuul of atoom dat graag elektronen afstaat.
V: Hoe treden additiereacties op tussen elektrofielen en nucleofielen?
A: Additiereacties treden op tussen elektrofielen en nucleofielen wanneer het nucleofiel het elektrofiel aanvalt en een nieuwe binding vormt.
V: Kan een elektrofiel een negatieve lading hebben?
A: Een elektrofiel kan een positieve lading hebben, maar ook een gedeeltelijk positieve lading of helemaal geen lading. Het belangrijkste kenmerk is dat het bereid is elektronen te accepteren.
Zoek in de encyclopedie