Anfinsens dogma — eiwitvouwing, Levinthal-paradox en prionen
Anfinsens dogma, eiwitvouwing en Levinthal-paradox uitgelegd — prionen, amyloïden en gevolgen voor Alzheimer en eiwitmisvouwing helder beschreven.
Anfinsen's dogma is een klassieke hypothese in de moleculaire biologie die voor het eerst door Christian Anfinsen werd geformuleerd. Kort gezegd stelt het dogma dat het vouwen van een eiwit tot zijn oorspronkelijke structuur in principe volledig wordt bepaald door de aminozuursequentie van dat eiwit. Dit geldt onder geschikte omstandigheden en voor veel, maar niet alle, eiwitten; sommige hebben hulp nodig van chaperones of andere factoren om correct te vouwen.
Anfinsen's experimenten en betekenis
Anfinsen toonde met experimenten aan dat het enzym ribonuclease A na denaturatie weer zijn activiteit en ruimtelijke structuur kan terugwinnen wanneer de denaturerende omstandigheden worden opgeheven en de juiste chemische condities (bijv. vorming van disulfidebruggen) mogelijk zijn. Dit resultaat was de kern van zijn redenering en droeg bij aan het werk waarvoor hij de Nobelprijs voor de Scheikunde in 1972 deelde. Zijn bevindingen laten zien dat de primaire aminozuursequentie belangrijke informatie bevat voor de gevouwen structuur, maar zeggen niet dat alle biologische omstandigheden (zoals posttranslationele modificaties, cofactoren, intracellulaire omgeving) altijd overbodig zijn.
Voorwaarden van het dogma
- Uniekheid — de sequentie moet een unieke gevouwen configuratie hebben; dat wil zeggen dat er geen andere configuratie bestaat met vergelijkbare vrije energie die concurrerend stabiel is.
- Stabiliteit — de inheemse structuur is robuust: kleine veranderingen in omgeving of omstandigheden mogen niet leiden tot overschakeling naar een totaal andere minimale energieconfiguratie.
- Kinetische toegankelijkheid — de eindconformatie moet bereikbaar zijn binnen realistische biologische tijden zonder dat het eiwit een onmogelijk lange reeks willekeurige tussenstappen of ingewikkelde knopen moet doorlopen.
Levinthal-paradox en hedendaagse verklaring
Levinthal stelde het probleem dat het aantal mogelijke conformaties voor een eiwit astronomisch groot is; theoretisch zou een volledige willekeurige zoektocht naar de laagste energietoestand absurd veel tijd kosten (veel langer dan de leeftijd van het heelal). In de praktijk vouwen eiwitten echter snel (milliseconden tot seconden). Dit schijnbare conflict staat bekend als Levinthal's paradox.
De moderne verklaring is dat eiwitten niet willekeurig alle mogelijke toestanden doorlopen, maar een gerichte zoektocht uitvoeren over een energielandschap dat vaak wordt voorgesteld als een “folding funnel”: lokale interacties en secundaire structuren (zoals helices en bladen) vormen zich snel en leiden het molecuul richting de inheemse toestand. Tussenstaten, kinetische barrières en overgangsstaten bepalen het pad en de snelheid. Bovendien voorkomen sommige mechanismen (zoals chaperones) aggregatie en begeleiden ze de route naar de correcte vouwing.
Computatie en modellen (inclusief recente AI-gebaseerde voorspellingen) bevestigen dat de sequentie veel informatie bevat over de structuur, maar tonen ook aan dat evolutionaire informatie, fysische chemie en soms hulp van andere moleculen nodig zijn om de biologische gevouwen toestand betrouwbaar te voorspellen.
Chaperones, cofactoren en andere uitzonderingen
In de cel komen extra factoren in beeld die het eenvoudige beeld van het dogma nuanceren. Chaperones (zoals Hsp70 en het GroEL/GroES-systeem) helpen bij het vermijden van misvouwing en aggregatie, houden ongevouwen of deels gevouwen eiwitten in een geschikte toestand, of geven een afgesloten omgeving waarin correct vouwen efficiënter verloopt. Sommige eiwitten hebben cofactoren, metalen, membraan-omgevingen of posttranslationele modificaties nodig voor de definitieve structuur en functie.
Bovendien bestaan er zogenaamde intrinsiek ongeordende eiwitten die in hun functionele toestand geen vaste compacte structuur aannemen; hun “vouwing” is contextafhankelijk en vaak gerelateerd aan interacties met andere moleculen.
Prionen en andere uitzonderingen
Prionen vormen een belangrijke uitzondering op Anfinsen's dogma. Prionproteïnen kunnen een alternatieve, stabiele conformatie aannemen die verschilt van de normale inheemse vouwing en die andere exemplaren van hetzelfde eiwit kan “templaten” om dezelfde foutieve conformatie aan te nemen. Dit leidt tot zelfversterkende propagatie van de misgevouwen vorm. Bij ziekten zoals boviene spongiformeencefalopathie (BSE) en Creutzfeldt–Jakob-ziekte veroorzaakt die wisseling van conformatie de vorming van resistente amyloïde fibrillen en weefselbeschadiging.
Andere amyloïde ziekten — waaronder de ziekte van Alzheimer en de ziekte van Parkinson — worden ook geassocieerd met eiwitaggregatie en misvouwing. Hoewel het mechanisme niet altijd identiek is aan klassieke prionen, tonen deze ziektes aan dat eiwitten soms alternatieve, pathologicaly stabiele conformaties kunnen aannemen die niet door het simpele dogma worden verklaard.
Samenvatting
Het dogma van Anfinsen is een krachtige en historische leidraad: de aminozuursequentie bevat veel van de informatie die nodig is voor het bereiken van de functionele structuur van een eiwit. In de praktijk bepalen echter ook het energielandschap, kinetische paden, moleculaire helpers (zoals chaperones), cofactoren en cellulaire context of en hoe dat vouwen plaatsvindt. Prionen en amyloïde-ziekten laten zien dat alternatieve, stabiele conformaties mogelijk zijn en dat misvouwing ernstige biologische gevolgen kan hebben.
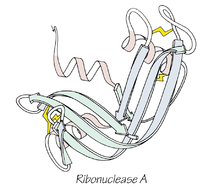
Gevouwen, 3-D structuur van ribonuclease A
Vragen en antwoorden
V: Wat is het dogma van Anfinsen?
A: Het dogma van Anfinsen is een hypothese in de moleculaire biologie, voorgesteld door Christian Anfinsen, die suggereert dat het vouwen van een eiwit in zijn oorspronkelijke structuur automatisch gebeurt door de aminozuursequentie van het eiwit.
V: Wat zijn de drie voorwaarden voor uniciteit, stabiliteit en kinetische toegankelijkheid?
A: Uniekheid vereist dat de sequentie geen andere configuratie heeft met een vergelijkbare vrije energie. Stabiliteit betekent dat kleine veranderingen in de omgeving niet kunnen leiden tot veranderingen in de minimale configuratie. Kinetische toegankelijkheid betekent dat de uiteindelijke vorm kan worden verkregen zonder zeer complexe veranderingen in de vorm (zoals bijvoorbeeld knopen).
V: Wat is de paradox van Levinthal?
A: De Levinthal-paradox stelt dat het aantal mogelijke conformaties waarover een bepaald eiwit beschikt astronomisch groot is, zodat zelfs een klein eiwit van 100 residuen meer tijd nodig heeft dan het universum bestaat om alle mogelijke conformaties te verkennen (1026 seconden) en de juiste te kiezen.
V: Zijn er uitzonderingen op het dogma van Anfinsen?
A: Ja, prionen en amyloïde ziekten zoals boviene spongiforme encefalopathie (gekkekoeienziekte), de ziekte van Alzheimer en de ziekte van Parkinson zijn uitzonderingen op het dogma van Anfinsen.
V: Hoe heeft Christian Anfinsen zijn Nobelprijs gewonnen?
A: Christian Anfinsen kreeg zijn Nobelprijs voor Scheikunde voor zijn werk aan de structuur van het enzym ribonuclease A.
V: Waarin verschillen prionen van de oorspronkelijke vouwtoestand?
A: Prionen zijn stabiele conformaties van eiwitten die verschillen van de oorspronkelijke vouwtoestand.
Zoek in de encyclopedie