Kleuring in microscopie: definitie, technieken en toepassingen
Ontdek wat kleuring in microscopie betekent, welke technieken bestaan en hoe toepassingen in biologie en geneeskunde cellen en weefsels duidelijk maken voor onderzoek en diagnose.
Kleuring wordt gebruikt bij microscopie om cellen en weefsels beter te kunnen zien en begrijpen. Dit verhoogt het contrast in het microscopische beeld en maakt bepaalde structuren selectief zichtbaar. Vlekken en kleurstoffen worden veel toegepast in de biologie en de geneeskunde om details in biologische preparaten uit te lichten, vaak in combinatie met verschillende microscopen.
Wat is kleuring en waarom wordt het gebruikt?
Kleuring is het aanbrengen van kleurstoffen of markers op een preparaat zodat onderdelen van cellen of weefsels duidelijker zichtbaar worden onder de microscoop. Zonder kleuring zijn veel structuren bijna kleurloos en dus moeilijk te onderscheiden. Kleuring helpt bij:
- Identificatie van celtypen, bacteriën en weefselarchitectuur.
- Diagnose van ziekten in de pathologie en microbiologie.
- Onderzoek naar celstructuren, eiwitten en moleculaire processen.
Basisprincipes
Kleurstoffen binden op verschillende manieren: elektrostatisch aan geladen moleculen, door hydrofobe interactie, covalent aan specifieke groepen, of via antilichaam-antigeen interactie. Kleuring kan plaatsvinden op levend weefsel (in vivo) of op dood weefsel of vaste preparaten (in vitro). De keuze van kleuring hangt af van het doel, het tipo preparaat en de gebruikte microscopie-techniek.
Veelgebruikte kleuringstechnieken
- Eenvoudige kleuringen — één kleurstof om algemene structuren zichtbaar te maken (bijv. methyleenblauw).
- Differentiële kleuringen — onderscheiden van type cellen of organismen:
- Gram-kleuring: onderscheid tussen Gram-positieve en Gram-negatieve bacteriën.
- Ziehl–Neelsen: voor zuurvaste bacteriën (bv. Mycobacterium).
- Hematoxyline en eosine (H&E) — standaard in histopathologie: hematoxylin kleurt kernen blauw, eosine cytoplasma en extracellulaire structuren roze.
- Specifieke histochemische kleuringen — bijvoorbeeld PAS (voor koolhydraten), Masson’s trichrome (voor bindweefsel), en Prussian blue (voor ijzer).
- Immunokleuring / immunohistochemie (IHC) — antilichamen binden specifiek aan proteïnen; detectie met enzymen (chromogeen) of fluorescente labels.
- Fluorescentiekleuring — labels zoals DAPI, FITC, Alexa- of Cy-dyes en fluorescente eiwitten (bijv. GFP) maken specifieke structuren zichtbaar met fluorescentiemicroscopie.
- Vitale en levend-cel kleurstoffen — Calcein-AM (levende cellen), Propidiumiodide (dode cellen), Hoechst/DAPI (nucleïnezuren) voor levende of kortdurende observaties.
- Elektronenmicroscopie — contrasting met zware metalen (uranylacetaat, loodcitraat) om ultrastructuur zichtbaar te maken.
Algemene stappen bij kleuring
- Fixatie — stabiliseert cellen/weefsels en voorkomt ontbinding (bv. formaldehyde, glutaraldehyde).
- Insluiten en snijden — vaste monsters worden ingebed (parafine of resin) en in dunne snedes gesneden.
- Permeabilisatie — sommige protocollen vereisen permeabilisatie (bv. met detergent) om kleurstoffen of antilichamen binnen te laten.
- Blokkering — voorkomt on-specifieke binding bij immunokleuring (bv. met serum of BSA).
- Incubatie met kleurstof of antilichaam — primaire en eventueel secundaire antilichamen of directe kleurstoffen.
- Wassen — verwijdert overtollige kleurstof om achtergrond te verminderen.
- Contra-kleuring en mounting — tegenkleurstoffen voor meer contrast en een geschikte mounting medium voor langdurige bewaring.
Toepassingen
- Pathologie — diagnosticeren van tumoren, ontstekingen en andere weefselaandoeningen met H&E en IHC.
- Microbiologie — identificatie en classificatie van bacteriën en schimmels (Gram, Ziehl–Neelsen).
- Celbiologie en onderzoek — lokalisatie van eiwitten, organellen en signaalroutes met fluorescentie en GFP-tagging.
- Neurowetenschappen — traceren van neurale verbindingen en identificatie van celtypen met specifieke markers.
- Klinische diagnostiek — detectie van pathogenen, biomarkers en weefselveranderingen voor behandelbeslissingen.
Keuze van kleurstof en beperkingen
De keuze hangt af van:
- Het doel (morfologie vs. specifieke moleculaire markers).
- Het preparaattype (levend of gefixeerd) en microscopiemethode (brightfield vs. fluorescence).
- Beschikbaarheid van geschikte antilichamen of probes en de gevoeligheid/nauwkeurigheid die nodig is.
Kwaliteitscontrole en veiligheid
- Gebruik positieve en negatieve controles om betrouwbaarheid van de kleuring te bevestigen.
- Werk met juiste fixatieven en disposables, en volg veiligheidsmaatregelen bij toxische reagentia (bijv. formaldehyde, organische oplosmiddelen, sommige kleurstoffen).
- Documenteer protocollen en bewaar monsters correct om reproduceerbaarheid te garanderen.
Kleuring blijft een essentieel hulpmiddel binnen de biologie en de geneeskunde omdat het inzichten geeft die zonder kleurstaining onzichtbaar blijven. Door de combinatie van traditionele kleurstoffen met moderne technieken zoals immunofluorescentie en fluorescentie-eiwitten zijn de mogelijkheden voor detectie en analyse de afgelopen decennia sterk uitgebreid.
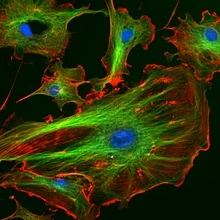
Geavanceerde microscopie: Nuclei zijn blauw gekleurd met DAPI, microtubles zijn groen gemarkeerd door een antilichaam en actinefilamenten zijn rood gelabeld met falloidine.

Een typische microscoopopstelling. Een gekleurd preparaat op een glazen objectglaasje wordt op de tafel van een microscoop geplaatst.
Bereiding
Dood weefsel moet worden "gefixeerd" zodat het niet vergaat. Het fixeermiddel houdt de structuur zoals die is. Na fixatie kan een weefsel in dunne plakjes worden gesneden en op een reeks glazen microscoopglaasjes worden gelegd. Soms moeten de celmembranen worden opgelost zodat grote kleurstofmoleculen in de cellen kunnen komen. De normen worden gepubliceerd in het tijdschrift Biotechnic & Histochemistry.
Kleuring
De eenvoudigste manier is om het objectglaasje en het preparaat in een kleurstofoplossing te dompelen, vervolgens af te spoelen en te onderzoeken. De gebruikte kleurstoffen zijn gecertificeerde kleurstoffen, getest door de Commissie voor biologische kleurstoffen.
Bacteriën kleuren
Gramkleuring wordt gebruikt om bacteriën te classificeren. Het is gebaseerd op de samenstelling van hun celwand. Gramkleuring maakt gebruik van kristalviolet om de celwanden te kleuren, jodium als beitsmiddel en een tegenkleuring die alle bacteriën markeert.
Gram-positieve bacteriën kleuren donkerblauw of violet. Hun celwand mist het secundaire membraan en de lipopolysaccharidelaag die Gram-negatieve bacteriën wel hebben.
Op de meeste Gram-gekleurde preparaten zijn Gram-negatieve organismen rood of roze van de tegenkleuring.
Kleuring van weefsels
Hematoxyline- en eosinekleuring wordt vaak gebruikt in de histologie voor dunne weefselcoupes. Hematoxyline kleurt de celkernen blauw, terwijl eosine het cytoplasma, het bindweefsel en andere extracellulaire stoffen roze of rood kleurt.
Eosine wordt sterk geabsorbeerd door rode bloedcellen, waardoor deze helderrood kleuren. In een vakkundig gemaakt H & E-preparaat zijn de rode bloedcellen bijna oranje, en worden collageen en cytoplasma (vooral spieren) verschillende tinten roze. Hematoxyline kleurt de celkern en andere zure structuren (zoals RNA-rijke delen van het cytoplasma en de matrix van hyalien kraakbeen) blauw. Eosine daarentegen kleurt het cytoplasma en het collageen roze.
Een snelle en eenvoudige kleuring op bloeduitstrijkjes en menselijke wangcellen is methyleenblauw, dat de kernen kleurt. Er zijn vele andere gespecialiseerde vlekken, sommige fluorescerend onder speciaal licht.
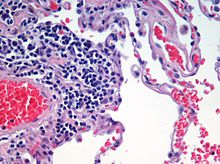
Microscopisch beeld van een histologisch specimen van menselijk longweefsel gekleurd met hematoxyline en eosine
Zoek in de encyclopedie