Carbeen (carbene): definitie, singlet vs triplet, reactiviteit en toepassingen
Carbeen (carbene): reactieve koolstofspecies met singlet vs triplet elektronconfiguraties, krachtige additie- en cheletropische reactiviteit en toepassingen zoals Grubbs-katalysatoren.
Een carbeen is een bijzonder reactief organisch intermediair: een molecuul waarin een koolstofatoom slechts twee σ-bindingen aangaat en twee andere elektronen bezit die niet in bindingen gebruikt worden. Omdat de centrale koolstof daardoor maar zes valentie-elektronen rond zich heeft, is een carbeen elektronarm en vaak zeer reactief. De eenvoudige algemene formule wordt weergegeven als R-(C:)-R' (waar “:” de niet-bindende elektronen weergeeft).
Elektronische structuur: singlet versus triplet
Carbenen kunnen twee elektronische grondtoestanden hebben: een singlet-toestand en een triplet-toestand.
- Singlet: de twee niet-bindende elektronen vormen een gepaarde lone pair in één orbital (meestal een gehybridiseerde orbital), terwijl een lege p-orbital aanwezig is. In veel gevallen is een singlet-carbeen bent (gebogen) met een bindingshoek rond ~100–130° en vertoont het chemisch gedrag dat vaak elektrofiel en/of nucleofiel kan zijn afhankelijk van substituenten.
- Triplet: de twee elektronen zitten ongepaard in twee verschillende orbitalen met gelijke spin, waardoor het carbeen zich als twee radicale centra gedraagt. Triplet-carbenen vertonen vaak een meer lineaire geometrie en geven in reacties meestal een stap-voor-stap (radicaalachtige) mechaniek.
De relatieve energie (singlet–triplet splijting) hangt sterk af van substituenten: groepen die elektronendelen of π-stabilisatue (bijv. heteroatomen met vrije paren of geconjugeerde systemen) neigen naar stabilisatie van de singlet-toestand, terwijl substituenten die radicalen stabiliseren (via hyperconjugatie of resonantie) de triplet-toestand kunnen bevoordelen. Een klassiek voorbeeld: methyleen (:CH2) heeft in het gasstadium een triplet-grondtoestand.
Geometrie en hybridisatie
In singlet-carbenen is de centrale koolstof vaak sp2-gehybridiseerd: één hybrid orbital bevat het lone pair, twee hybrid orbitals vormen de σ-bindingen met substituenten, en de lege p-orbital staat loodrecht op het vlak. Triplet-carbenen hebben meestal minder hybridisatie en de ongepaarde elektronen bezetten orthogonale orbitalen; dat beïnvloedt zowel hoekgroottes als reactiviteit.
Hoe worden carbenen gegenereerd en waargenomen?
Omdat de meeste carbenen kortlevende intermediairen zijn, worden ze vaak in situ gevormd uit geschikte voorlopers. Gebruikelijke bronnen en methoden:
- thermische of fotochemische ontledingen van diazoverbindingen (lossen van N2);
- α-eliminatie van halogen-substitueerde verbindingen (bijv. haloform-achtige routes);
- ontleding van diazirines of andere cyclische voorstadia;
- metallische routes: metal-carbenoïden of overgangsmetaal-carbenecomplexen (vaak belangrijk in katalyse);
- Simmons–Smith-achtige reacties waarbij een carbene-achtig methyleen-equivalent (carbenoïde) ontstaat uit CH2I2 en Zn–Cu.
Carbenen worden karakteriseerd met uiteenlopende technieken: EPR (ESR) is gevoelig voor triplet- en radicaalachtige toestanden, NMR kan singlet-carbenen detecteren als ze persistent genoeg zijn, en snelle spectroscopische methoden (tijd-resolved UV/vis, IR) of trapping-experimenten (reactie met een vangmiddel) worden veel gebruikt om hun aanwezigheid en eigenschappen te bevestigen.
Reactiviteit
Carbenen zijn veelzijdig en kunnen verschillende typen reacties aangaan:
- Additie aan C=C-bindingen — cyclopropanatie is een veelvoorkomende transformatie: een singlet-carbeen geeft vaak stereospecifieke (concerted) additie, terwijl een triplet-carbeen via een radicaalmechanisme kan verlopen en racemisatie of verlies van stereospecificiteit kan veroorzaken.
- Insertie in X–H-bindingen (bijv. C–H, O–H, N–H) — carbenen kunnen in bestaande σ-bindingen inserten en zo nieuwe C–X bindingen vormen.
- Vorming van yliden — reactie met heteroatomen (O, S, P) kan leiden tot yliden (bv. oxonium- of sulfoniumyliden), belangrijk in Wittig-achtige en rearrangatiereacties.
- Cheletropische reacties — carbenen kunnen optreden in cheletropische reacties (bijv. gesloten-ringvormende processen).
- Complexvorming met metalen — carbenen vormen stabiele metal-carbenecomplexen die een cruciale rol spelen in katalytische processen zoals olefine-metathese.
Stabiliteit: waarom sommige carbenen persistent zijn
Hoewel de meeste carbenen vluchtig en kortlevend zijn, bestaan er ook stabiele of "persistente" carbenen. Stabiliserende factoren:
- Sterische afscherming — grote substituenten rond het carbencentrum verhinderen bimoleculaire dimerisatie of snelle reactieve aanvallen;
- Elektronendeling / resonantie — heteroatomen (N, O) die elektronendeling naar de lege p-orbital geven, of conjugatie met aromatische systemen, verlagen de energie van de singlet-toestand;
- Ligatie aan metalen — metal-carbenecomplexen kunnen zeer stabiel zijn en worden intensief gebruikt in de katalyse.
Een historisch belangrijke vrije, stabiele carbene is het Arduengo-carbene (een type N-heterocyclisch carbene, NHC) dat geïsoleerd kon worden en bij kamertemperatuur bestendig is. Ook NHC's worden veel als liganden gebruikt in organometallic chemie en katalyse.
Let op: de bekende Robert Grubbs-katalysator is geen vrij carbene maar een ruthenium–carbene complex dat centraal staat in olefine-metathese. De tweede generatie Grubbs-katalysatoren bevatten vaak een N-heterocyclisch carbene-ligand dat de prestaties en stabiliteit van de katalysator verbetert.
Toepassingen
Carbenen en carbene-achtige species spelen een grote rol in de moderne organische synthese en katalyse:
- cyclopropaneringen (synthese van cyclische structuren);
- insertiereacties voor functionalisatie van alkanen (C–H-insertie);
- olefine-metathese via metal-carbenecomplexen (belangrijk in zowel de academische als industriële synthetische chemie);
- NHC-liganden verbeteren selectiviteit en levensduur van katalysatoren in diverse cross-coupling en metatheseprocessen;
- toepassingen in materialenchemie en als organokatalysatoren in specifieke transformaties.
Veiligheid en praktisch gebruik
Vrije carbenen zijn vaak extreem reactief en worden meestal niet opgeslagen maar in situ gegenereerd en direct benut. In laboratoria worden daarom veilige voorstadia (zoals diazoverbindingen of diazirines) en gecontroleerde methoden gebruikt. Metallische carbenen en persistente NHC's zijn veel praktischer en veiliger in gebruik bij synthetische toepassingen.
Samengevat: carbenen zijn elektronarme, tweewaardige koolstofoxiden met unieke eigenschappen. Of ze nu singlet of triplet zijn, bepaalt sterk hun geometrie en reactiemechanismen. Door substituenten, sterische bescherming of metaalbinding kunnen carbenen gestabiliseerd en nuttig gemaakt worden in talloze synthetische en katalytische toepassingen.
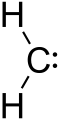
Een carbene
Vragen en antwoorden
V: Wat is een carbeen?
A: Een carbeen is een molecuul met een koolstofatoom dat twee bindingen heeft en twee andere elektronen die geen bindingen maken.
V: Waarom is een carbeen reactief?
A: De koolstof in een carbeen heeft slechts 6 elektronen om zich heen, waardoor het vrij reactief is.
V: Wat is de algemene formule voor een carbeen?
A: De algemene formule voor een carbeen kan worden geschreven als R-(C:)-R'.
V: Wat zijn de twee soorten carbeen?
A: De twee soorten carbeen zijn singlet en triplet.
V: Wat is het verschil tussen een singlet- en tripletcarbeen?
A: In een singletcarbeen zijn de twee elektronen die geen bindingen aangaan als een eenlingpaar en blijven ze in dezelfde baan. In een triplet carbeen blijven de twee elektronen in verschillende banen en hebben ze dezelfde spin.
V: Welke reacties kunnen carbenen uitvoeren?
A: Carbenen kunnen vele reacties uitvoeren. Ze kunnen zowel elektrofielen als nucleofielen zijn, en ze doen graag additiereacties op dubbele bindingen. Ze komen ook voor in cheletropische reacties.
V: Zijn carbenen stabiel?
A: De meeste carbenen zijn zeer onstabiel, maar sommige kunnen lang bestaan. Een voorbeeld is de katalysator van Grubbs, die werd ontwikkeld door Robert Grubbs.
Zoek in de encyclopedie