Cheletrope reactie | type pericyclische reactie
Een cheletropische reactie is een type pericyclische reactie waarbij één atoom op één van de reagentia twee nieuwe bindingen krijgt. Een pericyclische reactie is een reactie waarbij een overgangstoestand betrokken is met een cyclische array van atomen en een bijbehorende cyclische array van interacterende orbitalen. In deze cyclische array vindt een reorganisatie van σ- en π-bindingen plaats.
Cheletropische reacties zijn een subklasse van cycloaddities. Wat cheletropische reacties onderscheidt, is dat bij één van de reagentia beide nieuwe bindingen aan hetzelfde atoom worden gemaakt. Rechts in figuur 1 staan enkele voorbeelden. In het eerste geval is het ene atoom het koolstofatoom in de carbonylgroep. Dat koolstofatoom komt terecht in koolmonoxide. Het eindresultaat is het maken van twee nieuwe bindingen aan één atoom. De eerste twee voorbeelden staan bekend als "cheletropische extrusies", omdat bij de reactie een klein stabiel molecuul wordt afgegeven. De drijvende kracht achter deze reacties is vaak het entropische voordeel van het vrijkomen van een gas (bijv. CO of N2 ).

Figuur 1. Pericyclische reacties
Theoretische analyse
Vanwege de geometrie van de moleculen die betrokken zijn bij cheletropische reacties, bevestigen zij een aantal voorspellingen van theoretische chemici. Cheletropische reacties bevestigen het behoud van moleculaire orbitale symmetrie.
In de pericyclische overgangstoestand doneert een klein molecuul twee elektronen aan de ring. Twee mogelijke geometrieën kunnen de reactie verklaren. Het kleine molecuul kan zowel lineair als niet-lineair benaderen. In de lineaire benadering zijn de elektronen in de orbitaal van het kleine molecuul rechtstreeks gericht op het π-systeem van het grote molecuul. Bij de niet-lineaire benadering nadert de orbitaal onder een enigszins afwijkende hoek. Het vermogen van het π-systeem om te draaien als het kleine molecuul nadert, is cruciaal voor de vorming van nieuwe bindingen. De draairichting verschilt afhankelijk van het aantal π-elektronen in het systeem. Een diagram van een twee-elektron fragment dat een vier-elektron π-systeem nadert met behulp van frontier moleculaire orbitalen wordt hieronder getoond. De rotatie zal disrotatoir zijn als het kleine molecuul lineair nadert en conrotatoir als het molecuul niet-lineair nadert. Disrotatoir en conrotatoir geven aan hoe de bindingen in het π-systeem roteren. Disrotatoir betekent tegenovergestelde richting, terwijl conrotatoir dezelfde richting betekent. Dit wordt ook weergegeven in het onderstaande diagram.
Met behulp van de regel van Huckel kan worden bepaald of het π-systeem aromatisch of anti-aromatisch is. Indien aromatisch, gebruiken lineaire benaderingen disrotatoire bewegingen, terwijl niet-lineaire benaderingen conrotatoire bewegingen gebruiken. Het omgekeerde geldt voor een anti-aromatisch systeem. Lineaire benaderingen zullen een conrotatorische beweging hebben, terwijl niet-lineaire benaderingen een disrotatorische beweging zullen hebben.
Cheletropische reacties met SO2
Thermodynamica
Wanneer zwaveldioxide reageert met butadieen en isopreen, ontstaan er twee verschillende producten. Het reactiemechanisme bepaalt wat er gemaakt wordt. Een kinetisch product en een thermodynamisch product zijn beide mogelijk. Van het thermodynamische product wordt meer gemaakt dan van het kinetische product. Het kinetische product komt voort uit een Diels-Alderreactie, terwijl een cheletropische reactie een thermodynamisch stabieler product maakt. De cheletropische route wordt meer gebruikt omdat deze tot een stabieler adduct met vijf ringen leidt. Het onderstaande schema toont het verschil tussen de twee producten. Het pad links toont het thermodynamische product, terwijl het pad rechts het kinetische product toont. Suarez en Sordo toonden dit aan in 1995. Zij toonden dit zowel met experimenten als met Gaussiaanse berekeningen aan.
Kinetiek
Een voorbeeld hiervan zijn de cheletropische reacties van 1,3-dieen met zwaveldioxide. Chemici hebben zorgvuldig gekeken naar de kinetiek van deze reactie. In 1976 maten Isaacs en Laila de kenetische factoren voor de toevoeging van zwaveldioxide aan butadieenderivaten. De toevoegingssnelheid werd gecontroleerd in benzeen bij 30 °C met een aanvankelijke twintigvoudige overmaat aan diene. Zij gebruikten een spectrofotometer om het licht bij 320 nm te bestuderen om het verdwijnen van SO2 te meten. De reactie vertoonde een "pseudo-eerste-orde-kinetiek". De chemici ontdekten dat elektronenonttrekkende groepen op het diene de reactiesnelheid verminderden. Ook werd de reactiesnelheid aanzienlijk beïnvloed door sterische effecten van 2-substituenten, waarbij meer volumineuze groepen de reactiesnelheid verhoogden. (Met andere woorden, hoe groter de groep atomen die aan het tweede koolstofatoom hangt, hoe sneller de reactie verloopt). De auteurs schrijven dit toe aan de neiging van volumineuze groepen om de cisoïde conformatie van het diene te bevorderen, die essentieel is voor de reactie (zie onderstaande tabel). Bovendien werden de snelheden bij vier temperaturen gemeten voor zeven van de diënen. Op basis van deze metingen gebruikten chemici de Arrheniusvergelijking om voor elke reactie de enthalpie van activering (ΔH‡ ) en de entropie van activering (ΔS‡ ) te berekenen. Dit was een van de eerste belangrijke pogingen om de kenetiek van een cheletropische reactie te bestuderen.
| -Butadieen | 104 k /min−1 (30 °C) (± 1-2%) absoluut | 104 k /min−1 (30 °C) (± 1-2%) relatief | ΔH‡ /kcal mol−1 | ΔS‡ /cal mol−1 K−1 |
| 2-methyl | 1.83 | 1.00 | 14.9 | -15 |
| 2-ethyl | 4.76 | 2.60 | 10.6 | -20 |
| 2-isopropyl | 13.0 | 7.38 | 12.5 | -17 |
| 2-tert-butyl | 38.2 | 20.8 | 10.0 | -19 |
| 2-neopentyl | 17.2 | 9.4 | 11.6 | -18 |
| 2-cloro | 0.24 | 0.13 | N.V.T. | N.V.T. |
| 2-broomethyl | 0.72 | 0.39 | N.V.T. | N.V.T. |
| 2-p-tolyl | 24.7 | 13.5 | 10.4 | -19 |
| 2-fenyl | 17.3 | 9.45 | N.V.T. | N.V.T. |
| 2-(p-broomfenyl) | 9.07 | 4.96 | N.V.T. | N.V.T. |
| 2,3-dimethyl | 3.54 | 1.93 | 12.3 | -18 |
| cis-1-methyl | 0.18 | 0.10 | N.V.T. | N.V.T. |
| trans-1-methyl | 0.69 | 0.38 | N.V.T. | N.V.T. |
| 1,2-dimethyleen-cyclohexaan | 24.7 | 13.5 | 11.4 | -16 |
| 2-methyl-1,1,4,4-d4 | 1.96 | N.V.T. | N.V.T. | N.V.T. |
Monnat, Vogel en Sordo hebben in 2002 de kinetiek gemeten van de toevoeging van zwaveldioxide aan 1,2-dimethylidenecycloalkanen. Zij schreven dat de reactie van 1,2-dimethylidenecyclohexaan met zwaveldioxide twee verschillende producten kan opleveren, afhankelijk van de reactieomstandigheden. De reactie maakt het overeenkomstige sultine via een hetero-Diels-Alder reactie onder kinetische controle (≤ -60 °C), maar onder thermodynamische controle (≥ -40 °C) maakt de reactie het overeenkomstige sulfoleen via een cheletropische reactie. De activeringsenthalpie voor de hetero-Diels-Alder reactie is ongeveer 2 kcal/mol kleiner dan die voor de overeenkomstige cheletropische reactie. Het sulfoleen is ongeveer 10 kcal/mol stabieler dan het isometrische sultine in CH2 Cl2 /SO2 oplossing.
De auteurs konden experimenteel een snelheidswet uitwerken bij 261,2 K voor de reactie van 1,2-dimethylidenecyclohexaan met zwaveldioxide tot het overeenkomstige sulfoleen. De reactie was eerste orde in 1,2-dimethylidenecyclohexaan, maar tweede orde in zwaveldioxide (zie hieronder). Dit bevestigde een voorspelling van theoretische chemici op basis van hoogwaardige ab initio kwantumberekeningen. Met behulp van computationele methoden hebben de auteurs een overgangsstructuur voorgesteld voor de cheletropische reactie van 1,2-dimethylidenecyclohexaan met zwaveldioxide (zie figuur rechts). De reactie is tweede orde in zwaveldioxide omdat een andere zwaveldioxidemolecuul zich waarschijnlijk bindt aan de overgangstoestand om deze te helpen stabiliseren. Vergelijkbare resultaten werden gevonden in een studie uit 1995 van Suarez, Sordo en Sordo, die ab initio berekeningen gebruikten om de kinetische en thermodynamische controle van de reactie van zwaveldioxide met 1,3-dieen te bestuderen.
Effecten van oplosmiddelen
Het effect van het oplosmiddel van de cheletropische reactie van 3,4-dimethyl-2,5-dihydrothiofeen-1,1-dioxide (rechts getoond) werd kinetisch onderzocht in 14 oplosmiddelen. De reactiesnelheidsconstanten van de voorwaartse en omgekeerde reactie en de evenwichtsconstanten bleken lineair gecorreleerd met de ET (30) polariteitsschaal van het oplosmiddel.
De reacties vonden plaats bij 120 °C en werden bestudeerd met 1H-NMR-spectroscopie van het reactiemengsel. De voorwaartse snelheid k1 bleek met een factor 4,5 af te nemen van cyclohexaan naar methanol. De omgekeerde snelheid k-1 bleek met een factor 53 toe te nemen bij de overgang van cyclohexaan naar methanol, terwijl de evenwichtsconstante Keq met een factor 140 afnam. Er wordt gesuggereerd dat de polariteit tijdens het activeringsproces verandert, zoals blijkt uit de relaties tussen de evenwichts- en kinetische gegevens. De auteurs zeggen dat de reactie lijkt te worden beïnvloed door de polariteit van het oplosmiddel, en dit kan worden aangetoond door de verandering in de dipoolmomenten bij de overgang van reactant naar overgangstoestand naar product. De auteurs stellen ook dat de cheletropische reactie niet lijkt te worden beïnvloed door de zuurgraad of basiciteit van het oplosmiddel.
De resultaten van deze studie doen de auteurs de volgende gedragingen verwachten:
1. De verandering in de polariteit van het oplosmiddel zal de snelheid minder beïnvloeden dan het evenwicht.
2. De snelheidsconstanten worden gekenmerkt door een tegengesteld effect op de polariteit: k1 zal licht afnemen met de toename van ET (30), en k-1 zal toenemen onder dezelfde omstandigheden.
3. Het effect op k-1 zal groter zijn dan op k1 .
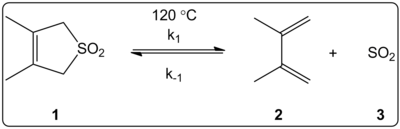
Cheletropische reactie bestudeerd in verschillende oplosmiddelen

Voorgestelde overgangstoestand voor de reactie van 1,2-dimethylideencyclohexaan met SO2 tot een sulfeen via een cheletropische reactie.

Reactie van 1,2-Dimethylidenecyclohexaan met SO2 geeft een Sultine via een Hetero-Diels-Alder reactie onder kinetische controle of een Sulfoleen via een Cheletropische reactie onder thermodynamische controle.
Carbeen toevoegingen aan alkenen
Een van de synthetisch belangrijkste cheletropische reacties is de toevoeging van een singlet carbeen aan een alkeen om een cyclopropaan te maken (zie figuur links). Een carbeen is een neutraal molecuul dat een tweewaardige koolstof bevat met zes elektronen in zijn valentieschil. Hierdoor zijn carbenen zeer reactieve elektrofielen en ontstaan ze als reactie-intermediair. Een singlet carbeen bevat een lege p orbitaal en een ongeveer sp2 hybride orbitaal met twee elektronen. Singletcarbenen voegen stereospecifiek toe aan alkenen, en de stereochemie van het alkeen blijft behouden in het cyclopropaanproduct. Het mechanisme voor toevoeging van een carbeen aan een alkeen is een gecoördineerde [2+1] cycloadditie (zie figuur). Carbenen uit chloroform of bromoform kunnen worden gebruikt om CX2 aan een alkeen toe te voegen, waardoor een dihalocyclopropaan ontstaat, terwijl het Simmons-Smith-reagens CH2 toevoegt.
Interactie van de gevulde carbeen orbitaal met het alkeen π systeem creëert een vier-elektron systeem en begunstigt een niet-lineaire benadering. Het is ook gunstig om de lege p orbitaal van het carbeen te mengen met de gevulde π orbitaal van het alkeen. Gunstige vermenging vindt plaats via een niet-lineaire benadering (zie figuur 2 rechts). Hoewel de theorie duidelijk de voorkeur geeft aan een niet-lineaire benadering, zijn er geen duidelijke experimentele implicaties voor een lineaire versus niet-lineaire benadering.

Figuur 2. A) De orbitalen voor singletcarbenen B) Niet-lineaire benadering van a) Carbeen sp2 orbitaal en b) Carbeen p orbitaal.

Toevoeging van een carbeen aan een alkeen om een cyclopropaan te vormen
Vragen en antwoorden
V: Wat is een cheletropische reactie?
A: Een cheletropische reactie is een soort pericyclische reactie waarbij één atoom op één van de reagentia twee nieuwe bindingen krijgt.
V: Wat is een pericyclische reactie?
A: Een pericyclische reactie is een reactie waarbij een overgangstoestand met een cyclische array van atomen en een bijbehorende cyclische array van interacterende orbitalen betrokken is, waarbij er een reorganisatie is van َ en ً bindingen.
V: Wat is het verschil met andere soorten reacties?
A: Cheletropische reacties zijn een subklasse van cycloaddities, en wat ze onderscheidt van andere typen reacties is dat bij een van de reagentia beide nieuwe bindingen aan hetzelfde atoom worden gemaakt.
V: Wat zijn enkele voorbeelden?
A: Voorbeelden zijn "cheletropische extrusies", zoals wanneer het enkele atoom in de carbonylgroep eindigt in koolmonoxide.
V: Wat drijft deze reacties aan?
A: De drijvende kracht achter deze reacties is vaak het entropische voordeel van het vrijkomen van een gas (bijv. CO of N2).
V: Houdt figuur 1 verband met cheletropische reacties? A: Ja, figuur 1 toont voorbeelden van cheletropische reacties.
Zoek in de encyclopedie
![{\displaystyle {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}](https://www.alegsaonline.com/image/a02f69dd0783356fbf24499f57d0df29cd264f16.svg)