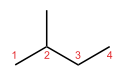Structuurisomeer
Structureel isomerisme (IUPAC noemt dit constitutioneel isomerisme) is een vorm van isomerisme. Twee chemische stoffen in dit isomerisme hebben dezelfde molecuulformule, maar de moleculen zijn in verschillende volgordes aan elkaar gebonden. Het tegenovergestelde van structureel isomerisme is stereoisomerisme. Er zijn veel woorden die staan voor structurele isomeren.
Er zijn drie soorten constitutionele isomeren. Dat zijn skeletisomeren, positie-isomeren en functionele isomeren. Positie-isomeren worden ook wel regio-isomeren genoemd. Tautomers zijn ook een soort functionele isomeren.
Skelet isomerisme
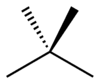
Bij skeletisomerisme, of ketenisomerisme, worden componenten van het skelet (meestal koolstof) opnieuw geordend om verschillende structuren te maken. Pentaan heeft drie isomeren. Dit zijn n-pentaan (vaak gewoon "pentaan" genoemd), isopentaan (methylbutaan) en neopentaan (dimethylpropaan).
| Skeletisomerisme van pentaan | ||
|
|
|
|
| n-Pentaan | Isopentaan | Neopentaan |
Positie isomerisme
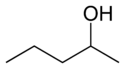
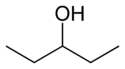
Bij positie-isomerisme verandert een functionele groep of een andere substituent van positie op een moederstructuur. In de tabel hieronder kan de hydroxylgroep op drie verschillende posities op een n-pentaanketen blijven om drie verschillende verbindingen te maken.
| Voorbeeld van positie-isomerisme | ||
|
|
|
|
| 1-Pentanol | 2-Pentanol | 3-Pentanol |
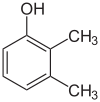
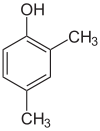
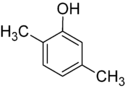
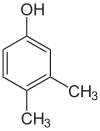
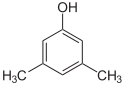
Er bestaan veel aromatische isomeren omdat substituenten op verschillende plaatsen aan de benzeenring kunnen worden geplaatst. Van fenol of hydroxybenzeen bestaat maar één isomeer, maar cresol of methylfenol heeft drie isomeren waarbij de extra methylgroep op drie verschillende plaatsen aan de ring kan worden geplaatst. Xylenol heeft één hydroxylgroep en twee methylgroepen en er bestaan in totaal 6 isomeren.
| Positie-isomeren van xylenol | ||
|
|
|
|
| 2,3-Xylenol | 2,4-Xylenol | 2,5-Xylenol |
|
|
|
|
| 2,6-Xylenol | 3,4-Xylenol | 3,5-xylenol |
Functionele groep isomerisme
Functionele isomeren zijn een van de structurele isomeren. Twee verbindingen in functioneel isomerisme hebben dezelfde molecuulformule (het aantal van elk atoom is hetzelfde, zoals cyclohexaan:C
6H
12 en 1-hexeen:C
6H
12). Maar de atomen zijn op andere manieren met elkaar verbonden, zodat de groeperingen verschillend zijn. We noemen deze groepen atomen functionele groepen, functionaliteiten, of moieties. Een andere manier om dit te zeggen is dat twee verbindingen die dezelfde molecuulformule hebben, maar verschillende functionele groepen hebben, functionele isomeren zijn.
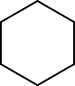
Bijvoorbeeld, de chemische formule van cyclohexaan en 1-hexeen zijn C6H12. We noemen ze functionele groep-isomeren omdat cyclohexaan een cycloalkaan is en hex-1-een een alkeen.
| Voorbeeld van isomerisme van functionele groepen | |
|
|
|
| 1-hexeen | |
Willen twee moleculen functionele isomeren zijn, dan moeten zij sleutelgroepen van atomen bevatten die op een bepaalde manier gerangschikt zijn. Enkele van de beste voorbeelden komen uit de organische chemie. C2H6O is een molecuulformule. Afhankelijk van hoe de atomen gerangschikt zijn, kan het twee verschillende verbindingen voorstellen: dimethylether CH3-O-CH3 of ethanol CH3CH2-O-H. Dimethylether en ethanol zijn functionele isomeren. De eerste is een ether. De functionaliteit koolstofketen-zuurstof-koolstofketen wordt een ether genoemd. Het tweede is een alcohol. De koolstof-keten-zuurstof-waterstof functionaliteit wordt een alcohol genoemd.
Als de functionaliteiten gelijk blijven, maar hun plaats verandert, zijn de structurele isomeren geen functionele isomeren. 1-Propanol en 2-propanol zijn structurele isomeren, maar het zijn geen functionele isomeren. Het zijn allebei alcoholen. De functionele groep (koolstofketen-O-H) is in beide verbindingen aanwezig, maar ze zijn niet hetzelfde.
Hoewel sommige scheikundigen de termen structureel isomeer en functioneel isomeer door elkaar gebruiken, zijn niet alle structurele isomeren ook functionele isomeren.
Functionele isomeren worden in de chemie het vaakst geïdentificeerd met behulp van infraroodspectroscopie. Infrarode straling komt overeen met de energieën die voornamelijk geassocieerd worden met moleculaire vibratie. De alcoholfunctionaliteit heeft een zeer duidelijke trilling die OH-stretch wordt genoemd en die het gevolg is van waterstofbinding. Alle alcoholen in vloeibare en vaste vorm absorberen infrarode straling bij bepaalde golflengten.
Verbindingen met dezelfde functionele groepen zullen allemaal bepaalde golflengten van infrarood licht absorberen als gevolg van de trillingen die met die groepen zijn verbonden. In feite is het infraroodspectrum verdeeld in twee gebieden. Het eerste deel wordt het gebied van de functionele groepen genoemd. Dimethylether en ethanol zouden verschillende infraroodspectra hebben in het functionele-groepengebied.
Het tweede deel van het infraroodspectrum wordt het vingerafdrukgebied genoemd; het wordt geassocieerd met soorten beweging die door de symmetrie van het molecuul worden toegestaan en worden beïnvloed door de bindingsenergieën. Het vingerafdrukgebied is meer specifiek voor een individuele verbinding. Hoewel 1-propanol en 2-propanol vergelijkbare infraroodspectra hebben in het functionele-groepengebied, verschillen zij in het vingerafdrukgebied.
Eenvoudig gezegd zijn functionele isomeren structurele isomeren die verschillende functionele groepen hebben, zoals alcohol en ether.
Isomeer tellen
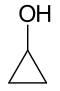
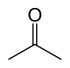
Als voorbeeld van het tellen van isomeren, bestaan er 7 structurele isomeren met molecuulformule C3H6O, elk met verschillende bindingsdichtheden en luchtstabiel bij omgevingstemperatuur. Nog eens twee structurele isomeren zijn de enol-tautomers van de carbonylisomeren, maar deze zijn niet stabiel.
| Moleculaire structuur | Smeltpunt (°C) | Kookpunt (°C) | Commentaar | |
| Allylalcohol |
| -129 | 97 | |
| Cyclopropanol |
| 101–102 | ||
| Propanal |
| - 81 | 48 | Tautomerisch met (E)-1-propenol en (Z)-1-propenol |
| Aceton |
| - 94.9 | 56.53 | Tautomerisch met 2-propenol |
| Oxetaan |
| - 97 | 48 | |
| Propyleen oxide |
| - 112 | 34 | Kan in twee enantiomeren worden opgelost |
| Methylvinylether |
| - 122 | 6 |
Zoek in de encyclopedie