Toestanden van materie: vast, vloeibaar, gas en plasma uitgelegd
Leer helder en snel over de vier toestanden van materie — vast, vloeibaar, gas en plasma — met eigenschappen, duidelijke voorbeelden en praktische toepassingen.
Er zijn vier algemene toestanden van materie (of fasen) in het heelal: vast, vloeibaar, gas en plasma. De toestand van de materie beïnvloedt de eigenschappen van een stof, zoals dichtheid, viscositeit (hoe goed hij vloeit), vervormbaarheid (hoe gemakkelijk hij buigt) en geleidbaarheid.
Wat bedoelen we met "toestand"?
Met de toestand van materie bedoelen we hoe de deeltjes (atomen, moleculen, ionen) ten opzichte van elkaar gerangschikt zijn en hoe ze bewegen. Die ordening en beweging bepalen eigenschappen zoals vastheid, vloeibaarheid, drukgevoeligheid en elektrische geleidbaarheid. Veranderingen tussen toestanden gebeuren door toevoegen of wegnemen van energie (meestal warmte) of door druk te veranderen.
Vast (solid)
- De deeltjes zitten dicht bij elkaar en hebben een vaste plaats of trillen rond een vaste ligging.
- Vaste stoffen hebben een vaste vorm en meestal een vaste volume. Ze zijn moeilijk te comprimeren.
- Voorbeelden: ijs, metalen, hout, kristallen.
- Bijzondere gevallen: sommige vaste stoffen, zoals glas, zijn amorfe en ontbreken een regelmatige kristalstructuur.
Vloeibaar (liquid)
- De deeltjes zitten dicht bij elkaar maar kunnen langs elkaar bewegen; daardoor heeft een vloeistof een vaste volume maar geen vaste vorm — hij past zich aan de vorm van de container aan.
- Belangrijke eigenschappen: viscositeit (stroperigheid) en oppervlaktespanning.
- Voorbeelden: water, olie, vloeibaar kwik.
Gas
- De deeltjes bewegen vrij en liggen ver van elkaar; een gas heeft geen vaste vorm en vult de ruimte waarin het zich bevindt.
- Gassen zijn goed comprimeerbaar en hun dichtheid verandert sterk met druk en temperatuur.
- Voorbeelden: lucht (mengsel van gassen), stoom (waterdamp).
Plasma
- Plasma is een geïoniseerde gasvorm: naast neutrale atomen komen vrij bewegende elektronen en ionen voor.
- Het geleidt elektriciteit goed en reageert sterk op magnetische en elektrische velden.
- Plasma is de meest voorkomende toestand in het heelal—de zon en sterren bestaan grotendeels uit plasma.
- Voorbeelden op aarde: bliksem, neonlicht, fluorescentielampen en industriële plasmatoepassingen (plasmacutters, oppervlaktetechniek).
Overgangsprocessen tussen toestanden
- Smelten (vast → vloeibaar) — voorbeelden: ijs smelt naar water.
- Stollen/bevriezen (vloeibaar → vast) — water wordt ijs.
- Verdampen/koken (vloeibaar → gas) en condenseren (gas → vloeistof).
- Sublimeren (vast → gas) en rijpen of deposities (gas → vast) — voorbeelden: droogijs (CO2) sublimatie, rijp op planten.
- Ionisatie (gas → plasma) en recombinatie (plasma → gas) — gebeurt bij hoge energie-inbreng of straling.
- Bij veel van deze veranderingen is energie-uitwisseling betrokken in de vorm van latent warmte: de temperatuur kan tijdelijk constant blijven terwijl de fase verandert.
Andere bijzondere toestanden
Naast de vier “klassieke” toestanden bestaan er nog bijzondere of extreme vormen van materie die in laboratoria of in de kosmos voorkomen:
- Superkritische vloeistoffen: bij hoge temperatuur en druk verdwijnen het onderscheid tussen vloeistof en gas (gebruikt als oplosmiddel in de industrie).
- Bose–Einsteincondensaat: een extreem koude toestand waarbij deeltjes zich quantumniveau als één golf gedragen (zichtbaar in geavanceerd onderzoek).
- Fermionencondensaten, kwark-gluonplasma (zeer hoge energie in deeltjesfysica) en andere exotische toestanden komen in gespecialiseerde contexten voor.
Waarom dit belangrijk is
De toestanden van materie en de overgangen daartussen verklaren veel alledaagse fenomenen (zoals koken, bevriezen en condensatie), maar zijn ook cruciaal in technologie en wetenschap: materialen ontwerpen, chemicaliën scheiden, energie-opslag, ruimtevaart en begrip van sterren en het heelal. Basiskennis van eigenschappen als dichtheid, viscositeit, vervormbaarheid en geleidbaarheid helpt bij het kiezen van materialen en processen in techniek en industrie.
Kort samengevat: de manier waarop de deeltjes in een stof gerangschikt zijn en hoe ze bewegen bepaalt of iets vast, vloeibaar, gas of plasma is, en kleine veranderingen in energie of druk kunnen die toestand veranderen.
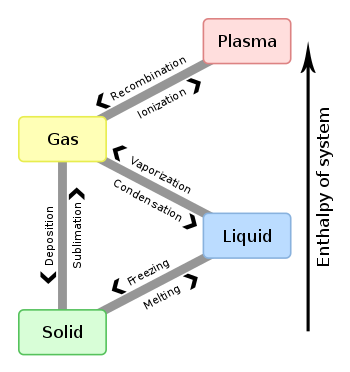
Veel voorkomende faseveranderingen in de natuur
Gemeenschappelijke toestanden van materie
Vaste stoffen
In een vaste stof zijn de posities van atomen ten opzichte van elkaar gedurende lange tijd gefixeerd. Dat komt door de samenhang of "wrijving" tussen de moleculen. Deze samenhang wordt geleverd door metallische, covalente of ionische bindingen. Alleen vaste stoffen kunnen door een kracht worden voortgeduwd zonder van vorm te veranderen, waardoor ze bestand zijn tegen vervorming. Vaste stoffen zijn doorgaans ook sterk genoeg om hun eigen vorm in een vat vast te houden. Vaste stoffen zijn over het algemeen dichter dan vloeistoffen. Een vaste stof die een gas wordt, heet sublimatie.
Vloeistoffen
In een vloeistof worden moleculen sterk genoeg tot elkaar aangetrokken om ze met elkaar in contact te houden, maar niet sterk genoeg om een bepaalde structuur vast te houden. De moleculen kunnen voortdurend ten opzichte van elkaar bewegen. Dit betekent dat vloeistoffen soepel kunnen stromen, maar niet zo soepel als gassen. Vloeistoffen hebben de neiging de vorm aan te nemen van de houder waarin zij zich bevinden. Vloeistoffen zijn over het algemeen minder dicht dan vaste stoffen, maar dichter dan gassen.
Gassen
In een gas zijn de chemische bindingen niet sterk genoeg om atomen of moleculen bij elkaar te houden, en daarom is een gas een verzameling onafhankelijke, niet-gebonden moleculen die voornamelijk door botsing met elkaar in contact komen. Gassen hebben de neiging de vorm van hun vat aan te nemen, en zijn minder dicht dan vaste stoffen en vloeistoffen. Gassen hebben zwakkere aantrekkingskrachten dan vaste stoffen en vloeistoffen. Gas dat direct een vaste stof wordt, heet afzetting.
Gassen kunnen soms rechtstreeks in vaste stoffen veranderen zonder door een vloeistoffase te gaan. Dat heet desublimatie. Je ziet het aan de rijp die zich in koude klimaten op ramen vormt. Het is het omgekeerde van sublimatie.
Plasma's
Plasma's zijn gassen die zoveel energie hebben dat de elektronen van een atoom niet in een baan rond een atoomkern kunnen blijven. De atoomionen en vrije elektronen mengen zich als een hete soep.
Omdat de positief en negatief geladen deeltjes niet aan elkaar vastzitten, is plasma een goede geleider van elektriciteit. Lucht bijvoorbeeld is niet goed in het geleiden van elektriciteit. Maar bij een bliksemschicht krijgen de atomen in lucht zoveel energie dat ze hun elektronen niet meer kunnen vasthouden, en worden ze voor korte tijd een plasma. Dan kan er een elektrische stroom door het plasma lopen, waardoor de bliksem ontstaat.
Plasma is de meest voorkomende materietoestand in het heelal. Zowel sterren als het interstellaire medium bestaan grotendeels uit plasma.
Faseveranderingen
Fasen van materie kunnen worden veranderd door een aantal zaken. De meest voorkomende zijn temperatuur en druk. Stoffen worden meestal een gas bij warme temperaturen en/of lage druk, worden een vaste stof bij koele temperaturen, en worden een plasma bij extreem hete temperaturen. Stoffen worden vaak vloeibaar tussen vast en gas in, maar als de druk erg laag is (zoals het vacuüm van de ruimte) slaan veel stoffen de vloeibare fase over en gaan direct van vast naar gas of omgekeerd. Wetenschappers hebben grafieken gemaakt, faseveranderingsdiagrammen genaamd, die het verband tonen tussen druk, temperatuur en fase van veel stoffen.
Als een vaste stof een vloeistof wordt, heet dat smelten. Als een vloeistof een vaste stof wordt, heet dat bevriezen. Als een vaste stof een gas wordt, heet dat sublimatie. Als een gas een vaste stof wordt, heet dat desublimatie. Als een vloeistof een gas wordt, heet dat verdamping. Wanneer een gas een vloeistof wordt, heet dat condensatie.
Men zegt dat het vriespunt en het smeltpunt gelijk zijn, omdat elke stijging van de temperatuur vanaf dat punt de stof doet smelten, terwijl elke daling van de temperatuur de stof doet bevriezen. Ook het verdampings- en condensatiepunt (of het sublimatie- en desublimatiepunt) komen altijd overeen. Bij de meeste stoffen neemt het verdampings-/condensatiepunt toe naarmate de druk toeneemt, of omgekeerd. Het kookpunt van water neemt bijvoorbeeld af als je een berg opgaat, omdat de luchtdruk lager is. De relatie voor bevriezen en smelten kan in verschillende richtingen gaan, afhankelijk van de stof.
Andere staten
Veel andere toestanden van materie kunnen onder speciale omstandigheden bestaan, waaronder vreemde materie, supervloeistoffen en mogelijk snoerloze vloeistoffen. Wetenschappers doen experimenten bij zeer hoge of zeer lage temperaturen om meer te weten te komen over materiefasen.
Condensaten
Bose-Einsteincondensaten en fermionische condensaten zijn fasen van materie die van toepassing zijn op deeltjes die respectievelijk bosonen en fermionen worden genoemd. (Meer dan één boson kan tegelijkertijd op dezelfde plaats bestaan. Slechts één fermion kan tegelijkertijd op dezelfde plaats bestaan). Bose-Einstein condensaten en fermionische condensaten komen voor bij ongelooflijk lage temperaturen (ongeveer 4° Kelvin, wat hetzelfde is als -452° Fahrenheit). Alle deeltjes in deze condensaten beginnen zich te gedragen als één grote kwantumtoestand, zodat ze bijna geen wrijving of elektrische weerstand hebben.
Ontaarde materie
Wanneer in de kern van een ster de lichte elementen (zoals waterstof of helium) opraken om de fusie in stand te houden, stort de kern ineen tot een zeer dichte toestand, die degeneratieve materie wordt genoemd. Alles zit heel dicht opeengepakt en kan nauwelijks bewegen. Als de ster niet te zwaar is, wordt hij een witte dwerg. Bij een zwaardere ster is de druk zo groot dat zelfs de protonen en elektronen worden verpletterd, en wordt het een neutronenster.
Quark-gluon plasma's
De protonen en neutronen waaruit atomen bestaan, zijn gemaakt van nog kleinere dingen, quarks genaamd (die aan elkaar zijn "gelijmd" door dingen die "gluonen" worden genoemd). Bij ongelooflijk hoge temperaturen van meer dan 2 biljoen Kelvin veranderen quarks en gluonen in een andere toestand van materie. Mensen kunnen een beetje quark-gluon plasma maken in de Large Hadron Collider in CERN, maar dat duurt niet lang voordat het afkoelt.
Superkritische vloeistoffen
Wanneer een stof genoeg temperatuur en druk tegelijk heeft, het kritieke punt genoemd, kun je het verschil niet meer zien tussen zeer dicht gas en zeer energierijke vloeistof. Dit is een superkritische vloeistof, die zich zowel als vloeistof en als gas gedraagt.
Superfluïda
Supervloeistoffen daarentegen ontstaan alleen bij zeer lage temperaturen, en alleen bij een paar speciale stoffen zoals vloeibaar helium. Supervloeistoffen kunnen dingen doen die gewone vloeistoffen niet kunnen, zoals tegen de wand van een schaal oplopen en eruit komen.
Zoek in de encyclopedie