Carbokation
Een carbokation is een ion met een positief geladen koolstofatoom. Het geladen koolstofatoom in een carbokation is een "sextet" (dat wil zeggen, het heeft slechts zes elektronen in zijn buitenste valentieschil in plaats van acht valentie-elektronen). Koolstofatomen met acht valentie-elektronen hebben de maximale stabiliteit (octet-regel). Daarom zijn carbokationen vaak reactief, op zoek om het octet van valentie-elektronen te vullen en een neutrale lading terug te krijgen. De logica zou zeggen dat carbokationen sp3 hybridisatie hebben, waarbij een lege sp3 orbitaal een positieve lading geeft. De reactiviteit van een carbokation lijkt echter meer op sp2 hybridisatie met een trigonale planaire moleculaire geometrie.
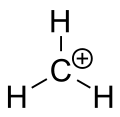
Carbenium ion van methaan

tert-butyl kation, dat planaire geometrie aantoont
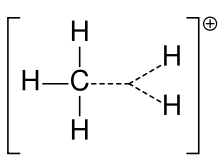
Carbonium ion van methaan
Definities
Een carbokation werd vroeger vaak een carboniumion genoemd, maar chemici betwijfelen de precieze betekenis. In de huidige scheikunde is een carbokation elk positief geladen koolstofatoom. Er zijn twee speciale types gesuggereerd: carbenium-ionen zijn driewaardig en carbonium-ionen zijn pentavalent of hexavalent. Leerboeken op universitair niveau bespreken carbokationen alleen alsof het carbeniumionen zijn, of bespreken carbokationen met een vluchtige verwijzing naar de oudere uitdrukking van carboniumion of carbenium en carboniumionen. Eén leerboek blijft tot op de dag van vandaag bij de oudere benaming van carboniumion voor carbeniumion en reserveert de uitdrukking hypervalent carbeniumion voor CH5+.
Geschiedenis
In 1891 meldde G. Merling dat hij broom aan tropylideen (cycloheptatriëen) had toegevoegd en het product vervolgens had verhit, waardoor een kristallijn, in water oplosbaar materiaal werd verkregen, C
7H
7Br. Hij stelde er geen structuur voor voor; Doering en Knox toonden echter overtuigend aan dat het tropylium (cycloheptatrienylium) bromide was. Volgens de regel van Hückel zou dit ion aromatisch zijn.
In 1902 ontdekten Norris en Kehrman onafhankelijk van elkaar dat kleurloze trifenylmethanol diepgele oplossingen gaf in geconcentreerd zwavelzuur. Triphenylmethylchloride vormde op vergelijkbare wijze oranje complexen met aluminium- en tinchloriden. In 1902 herkende Adolf von Baeyer het zoutachtige karakter van de gevormde verbindingen.

Hij noemde het verband tussen kleur en zoutvorming halochromie waarvan malachietgroen een uitstekend voorbeeld is.
Carbocaties zijn reactieve tussenproducten in veel organische reacties. Dit idee, voor het eerst voorgesteld door Julius Stieglitz in 1899, werd verder ontwikkeld door Hans Meerwein in zijn studie van 1922 over de Wagner-Meerwein herschikking. Carbocaties bleken ook betrokken te zijn bij de SN1reactie, de E1 reactie, en bij herschikkingsreacties zoals de Whitmore 1,2 verschuiving. De chemische wereld stond weigerachtig tegenover het begrip carbokation en het Journal of the American Chemical Society weigerde lange tijd artikelen waarin deze werden vermeld.
Het eerste NMR spectrum van een stabiel carbokation in oplossing werd gepubliceerd door Doering et al. in 1958. Het was het heptamethylbenzenonium ion, gemaakt door hexamethylbenzeen te behandelen met methylchloride en aluminiumchloride. Het stabiele 7-norbornadienyl-kation werd in 1960 door Story et al. bereid door norbornadienylchloride te laten reageren met zilvertetrafluoroboraat in zwaveldioxide bij -80 °C. Het NMR-spectrum stelde vast dat het niet-klassiek gebrugd was (het eerste stabiele niet-klassieke ion dat werd waargenomen).
In 1962 nam Olah het tert-butylcarbokation rechtstreeks waar met behulp van kernspinresonantie als een stabiele soort bij het oplossen van tert-butylfluoride in magisch zuur. De NMR van het norbornyl-kation werd voor het eerst gerapporteerd door Schleyer et al. en er werd aangetoond dat het proton-scrambling over een barrière ondergaat door Saunders et al.
Eigenschappen
In de organische chemie is een carbokation vaak het doelwit van nucleofiele aanvallen door nucleofielen zoals hydroxylionen (OH-ionen) of halogeenionen.
Carbocaties worden geclassificeerd als primair, secundair of tertiair, afhankelijk van het aantal koolstofatomen dat aan de geïoniseerde koolstof is gebonden. Primaire carbocaties hebben één of nul koolstofatomen die aan de geïoniseerde koolstof zijn gebonden, secundaire carbocaties hebben twee koolstofatomen die aan de geïoniseerde koolstof zijn gebonden en tertiaire carbocaties hebben drie koolstofatomen die aan de geïoniseerde koolstof zijn gebonden.
De stabiliteit van het carbokation neemt toe met het aantal alkylgroepen dat aan de ladingsdragende koolstof is gebonden. Tertiaire carbokationen zijn stabieler (en vormen zich gemakkelijker) dan secundaire carbokationen; primaire carbokationen zijn zeer onstabiel omdat, terwijl geïoniseerde hogere-orde-koolstoffen worden gestabiliseerd door hyperconjugatie, niet-gesubstitueerde (primaire) koolstoffen dat niet zijn. Daarom treden reacties als de SN1-reactie en de E1-eliminatiereactie normaliter niet op als er een primair carbokation zou worden gevormd. Een uitzondering hierop doet zich voor als er een dubbele koolstof-koolstof binding naast de geïoniseerde koolstof is. Zulke kationen als het allyl-kation CH2=CH-CH2+ en het benzyl-kation C6H5-CH2+ zijn stabieler dan de meeste andere carbokationen. Moleculen die allyl- of benzylcarbokationen kunnen vormen, zijn bijzonder reactief.
Carbocaties ondergaan herschikkingsreacties van minder stabiele structuren naar even stabiele of stabielere structuren met snelheidsconstanten van meer dan 109/sec. Dit feit bemoeilijkt de synthetische routes naar vele verbindingen. Wanneer bijvoorbeeld 3-pentanol met waterig HCl wordt verwarmd, herschikt het aanvankelijk gevormde 3-pentyl-carbokation zich tot een statistisch mengsel van 3-pentyl en 2-pentyl. Deze kationen reageren met het chloride-ion tot ongeveer 1/3 3-chloorpentaan en 2/3 2-chloorpentaan.
Sommige carbokationen, zoals het norbornyl-kation, vertonen min of meer symmetrische drie-centrumbindingen. Dergelijke kationen worden niet-klassieke ionen genoemd. Het energieverschil tussen "klassieke" carbokationen en "niet-klassieke" isomeren is vaak zeer klein, en er is in het algemeen weinig of geen activeringsenergie betrokken bij de overgang tussen "klassieke" en "niet-klassieke" structuren. De "niet-klassieke" vorm van de 2-butylcarbokation is in wezen 2-buteen met een proton direct boven het centrum van wat de dubbele koolstof-koolstofbinding zou zijn. "Niet-klassieke carbokeringen waren ooit het onderwerp van grote controverses. Een van George Olah's grootste bijdragen aan de scheikunde was het oplossen van deze controverse.
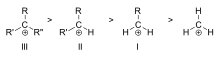
Volgorde van stabiliteit van voorbeelden van tertiaire (III), secundaire (II) en primaire (I) alkylcarbokaties
Specifieke carbocaties
Cyclopropylcarbinyl-kationen kunnen worden bestudeerd met NMR:

In het NMR-spectrum van een dimethylderivaat worden twee niet-gelijkwaardige signalen gevonden voor de twee methylgroepen, wat erop wijst dat de moleculaire conformatie van dit kation niet loodrecht staat (zoals in A) maar gehalveerd is (zoals in B) met de lege p-orbitaal en het cyclopropyl-ringsysteem in hetzelfde vlak:

In termen van de gebogen-bindingstheorie wordt deze voorkeur verklaard door aan te nemen dat er een gunstige overlap bestaat tussen de gevulde gebogen bindingen van cyclopropaan en de lege p-orbitaal.
Vragen en antwoorden
V: Wat is een carbokation?
A: Een carbokation is een ion met een positief geladen koolstofatoom.
V: Wat is de buitenste valentieschil van een carbokation?
A: De buitenste valentieschil van een carbokation heeft slechts zes elektronen in plaats van de stabiele acht valentie-elektronen.
V: Waarom zijn carbokationen vaak reactief?
A: Carbokationen zijn vaak reactief omdat zij proberen het octet valentie-elektronen op te vullen en een neutrale lading terug te krijgen.
V: Wat is de maximale stabiliteit voor koolstofatomen?
A: De maximale stabiliteit voor koolstofatomen wordt bereikt wanneer zij acht valentie-elektronen hebben.
V: Wat is een sextet in de scheikunde?
A: Een sextet is een term die wordt gebruikt om een koolstofatoom in een carbokation te beschrijven dat slechts zes elektronen in zijn buitenste valentieschil heeft in plaats van de stabiele acht valentie-elektronen.
V: Wat is de hybridisatie en moleculaire geometrie van een carbokation?
A: Hoewel de logica zou suggereren dat carbokationen sp3 hybridisatie hebben met een lege sp3 orbitaal die een positieve lading geeft, lijkt hun reactiviteit meer op sp2 hybridisatie met een trigonale planaire moleculaire geometrie.
V: Wat is de octetregel?
A: De octetregel is een principe in de scheikunde dat stelt dat atomen de neiging hebben chemische bindingen te vormen met andere atomen die beide atomen in staat stellen een stabiele set van acht valentie-elektronen te hebben.
Zoek in de encyclopedie