Batterij (elektrisch)
Een batterij zet chemische energie om in elektrische energie door een chemische reactie. Gewoonlijk worden de chemicaliën in de batterij bewaard. Hij wordt in een stroomkring gebruikt om andere componenten van stroom te voorzien. Een batterij produceert gelijkstroom (DC) elektriciteit (elektriciteit die in één richting stroomt, en niet heen en weer schakelt).
Het gebruik van elektriciteit uit een stopcontact in een gebouw is goedkoper en efficiënter, maar een batterij kan elektriciteit leveren in gebieden waar geen elektrische stroomdistributie is. Het is ook nuttig voor dingen die bewegen, zoals elektrische voertuigen en mobiele telefoons.
Batterijen kunnen primair of secundair zijn. De primaire wordt weggegooid wanneer ze niet langer stroom kan leveren. De secundaire kan worden opgeladen en hergebruikt.
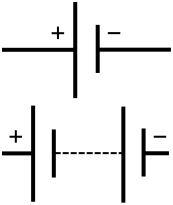
Schematisch symbool van een batterij

De chemie in een batterij
Een batterij kan uit één cel of uit vele cellen bestaan. Elke cel heeft een anode, een kathode en een elektrolyt. De elektrolyt is het belangrijkste materiaal in de batterij. Het is vaak een soort zuur, en kan gevaarlijk zijn om aan te raken. De anode reageert met de elektrolyt om elektronen te produceren (dit is de negatieve of - kant). De kathode reageert met de elektrolyt en neemt elektronen op (dit is de positieve of + kant). Er ontstaat een elektrische stroom wanneer een draad de anode met de kathode verbindt en de elektronen van het ene uiteinde naar het andere bewegen. (Maar een batterij kan worden beschadigd door alleen maar een draad die de twee uiteinden verbindt, dus is er ook een belasting nodig tussen de twee uiteinden. De belasting is iets dat de elektronen vertraagt, en gewoonlijk iets nuttigs doet, zoals een gloeilamp in een zaklamp, of de elektronica in een rekenmachine).De elektrolyt kan vloeibaar of vast zijn. Een batterij wordt een natte cel of een droge cel batterij genoemd, afhankelijk van het soort elektrolyt.
De chemische reacties die in een batterij optreden, zijn exotherme reacties. Bij dit soort reacties ontstaat warmte. Als u bijvoorbeeld uw laptop lange tijd aan laat staan en dan de batterij aanraakt, zal deze warm of heet worden.
Een oplaadbare batterij wordt opgeladen door de chemische reactie die in de batterij plaatsvindt om te keren. Maar een oplaadbare batterij kan slechts een bepaald aantal keren worden opgeladen (oplaadduur). Zelfs ingebouwde batterijen kunnen niet eeuwig worden opgeladen. Bovendien vermindert elke keer dat een batterij wordt opgeladen, haar vermogen om de lading vast te houden een beetje. Niet-oplaadbare batterijen mogen niet worden opgeladen omdat er verschillende schadelijke stoffen uit kunnen lekken, zoals kaliumhydroxide.
De cellen kunnen met elkaar worden verbonden om een grotere batterij te maken. Het verbinden van de positieve van een cel met de negatieve van de volgende cel wordt het in serie schakelen genoemd. De spanning van elke batterij wordt bij elkaar opgeteld. Twee batterijen van zes volt die in serie zijn geschakeld, maken 12 volt.
Het verbinden van de positieve van de ene cel met de positieve van de andere, en de negatieve met de negatieve, noemt men ze parallel schakelen. De spanning blijft gelijk, maar de stroom wordt bij elkaar opgeteld. Spanning is de druk die de elektronen door de draden duwt, het wordt gemeten in volt. De stroomsterkte is het aantal elektronen dat in één keer kan gaan, gemeten in ampère. De combinatie van stroom en spanning is het vermogen (watt = volt x ampère) van de batterij.
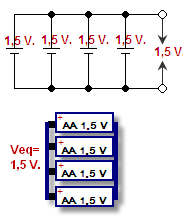
Parallel geschakelde batterijen - weergegeven in een schema en een tekening
Batterij maten
Batterijen zijn er in vele verschillende vormen, maten en voltages.AA-, AAA-, C- en D-cellen, met inbegrip van alkalinebatterijen, hebben standaardafmetingen en -vormen, en hebben ongeveer 1,5 volt. Het voltage van een cel hangt af van de gebruikte chemicaliën. De elektrische lading die een cel kan leveren hangt af van hoe groot de cel is en welke chemicaliën worden gebruikt. De lading die een batterij levert wordt meestal gemeten in ampère-uren. Aangezien de spanning gelijk blijft, betekent meer lading dat een grotere cel meer ampère kan leveren, of langer kan werken.
Geschiedenis
De eerste batterij werd in 1800 uitgevonden door Alessandro Volta. Tegenwoordig wordt zijn batterij de voltaïsche paal genoemd.In kleine, moderne batterijen is de vloeistof geïmmobiliseerd in een soort pasta en zit alles in een verzegelde behuizing. Door dit omhulsel kan er niets uit de batterij lopen. Grotere batterijen, zoals autoaccu's, hebben nog steeds vloeistof in zich en zijn niet verzegeld. Een soort batterij waarbij gesmolten zouten als elektrolyt worden gebruikt, werd uitgevonden tijdens de Tweede Wereldoorlog.
Soorten batterijen
- droge cellen, cellen die geen vloeistof bevatten (of die een geïmmobiliseerde vloeistof bevatten zoals een pasta of gel) als elektrolyt
- Primaire cel, cellen die niet kunnen worden opgeladen
- Alkalinebatterij, "alkaline", niet oplaadbaar
- Kwikbatterij, niet oplaadbaar
- Leclanche batterij, "super heavy duty", niet oplaadbaar
- Lithium batterij, niet oplaadbaar, "coin cell"
- Zilveroxide batterij, niet oplaadbaar, horloge batterij
- Voltaïsche stapel, Allesandro Voltas eerste batterij
- Secundaire cel, cellen die kunnen worden opgeladen
- Verzegelde lood-zuur batterij
- Lithium-ion batterij, oplaadbaar, gebruikt in mobiele telefoons en laptops
- Nikkel-cadmiumbatterij, "NiCd", oplaadbaar
- Nikkel-metaalhydride batterij, "NiMH", oplaadbaar
- Nikkel-zink batterij
- Natte cellen, cellen die vloeistof als elektrolyt bevatten
- Loodzuurbatterij, oplaadbare, autoaccu
- Nikkel-ijzer batterij, oplaadbaar, Edison batterij
- Brandstofcel, opgeladen door brandstof toe te voegen

Bovenaanzicht van de autoaccu
Alternatieven voor batterijen
Brandstofcellen en zonnecellen zijn geen batterijen omdat zij de energie niet in zich opslaan.Een condensator is geen batterij omdat hij de energie niet opslaat in een chemische reactie. Een condensator kan elektriciteit opslaan en veel sneller elektriciteit maken dan een batterij, maar het kost meestal te veel om hem zo groot te maken als een batterij kan zijn. Wetenschappers en scheikundig ingenieurs werken aan betere condensatoren en batterijen voor elektrische auto's.
Kleine elektrische generatoren die met de hand of de voet worden bediend, kunnen kleine elektrische apparaten van stroom voorzien. Uurwerkradio's, uurwerkfakkels en soortgelijke apparaten hebben ook een opwindveer om mechanische energie op te slaan.
Vragen en antwoorden
V: Wat is een batterij?
A: Een batterij is een apparaat dat chemische energie door een chemische reactie omzet in elektrische energie.
V: Hoe produceert een batterij elektriciteit?
A: Een batterij produceert gelijkstroom (DC), die in één richting stroomt en niet heen en weer schakelt.
V: Waar worden de chemicaliën in een batterij bewaard?
A: Gewoonlijk worden de chemicaliën in de batterij bewaard.
V: Wat is het verschil tussen een primaire en een secundaire batterij?
A: Een primaire batterij wordt weggegooid als hij geen elektriciteit meer kan leveren, terwijl een secundaire batterij kan worden opgeladen en hergebruikt.
V: Waarom zijn batterijen nuttig?
A: Batterijen zijn nuttig om elektriciteit te leveren in gebieden waar geen elektriciteitsdistributie is en voor dingen die bewegen, zoals elektrische voertuigen en mobiele telefoons.
V: Is het gebruik van elektriciteit uit een stopcontact in een gebouw goedkoper en efficiënter dan het gebruik van een batterij?
A: Ja, het gebruik van elektriciteit uit een stopcontact in een gebouw is goedkoper en efficiënter dan het gebruik van een batterij.
V: Welk type elektriciteit produceert een batterij?
A: Een batterij produceert gelijkstroom (DC).
Zoek in de encyclopedie