Benzeen
Benzeen, ook bekend als benzol, is een organische chemische verbinding met de formule C6H6. Het is een kleurloze en brandbare vloeistof met een zoete geur. Benzeenmoleculen bestaan uit een ring van zes koolstofatomen die elk gebonden zijn aan één waterstofatoom. Het is een aromatische verbinding, wat betekent dat de ring afwisselend dubbele bindingen heeft.
Benzeen is carcinogeen, wat betekent dat het kanker kan veroorzaken. Het heeft vele reële toepassingen. Het wordt gebruikt als additief in benzine, kunststoffen, synthetisch rubber, kleurstoffen en het is een industrieel oplosmiddel, wat betekent dat het vele andere chemische moleculen kan oplossen. Benzeen is ook een natuurlijk bestanddeel van ruwe olie en is daarom aanwezig in benzine. Veel geneesmiddelen bevatten onderdelen die van benzeen zijn gemaakt.
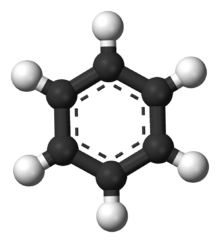
Model van een molecule van benzeen. Koolstofatomen zijn zwart weergegeven en waterstof wit.
_1964,_MiNr_440.jpg)
In 1964 gaf de Duitse postdienst een postzegel uit ter herdenking van 100 jaar ontdekking van benzeen
Structuur
Benzeen heeft speciale eigenschappen die aromaticiteit worden genoemd. Alle zes koolstofatomen in de ring liggen op hetzelfde platte vlak. Om alle bindingen van een zes-koolstofring te kunnen verklaren, moeten er afwisselend dubbele koolstofbindingen zijn (geconjugeerd systeem):
Als benzeen drie dubbele bindingen had, zouden drie zijden van de ring korter zijn dan de andere drie zijden. Röntgendiffractie toont aan dat alle zes koolstof-koolstofbindingen in benzeen dezelfde lengte hebben van 140 picometer (pm). De C-C bindingslengtes zijn groter dan een dubbele binding (135 pm) maar korter dan een enkele binding (147 pm). Deze tussenafstand is in overeenstemming met elektronendelokalisatie: de elektronen voor de C-C binding zijn gelijkelijk verdeeld over elk van de zes koolstofatomen. Het molecuul is planair. Een voorstelling is dat de structuur bestaat als een superpositie van zogenaamde resonantiestructuren, in plaats van één van beide vormen afzonderlijk. (Met andere woorden, de dubbele bindingen van het molecuul wisselen snel tussen paren van koolstofatomen). De delokalisatie van elektronen is één verklaring voor de thermodynamische stabiliteit van benzeen en verwante aromatische verbindingen. Het is waarschijnlijk dat deze stabiliteit bijdraagt tot de eigenaardige moleculaire en chemische eigenschappen die bekend staan als aromaticiteit. Om de gedelokaliseerde aard van de binding aan te geven, wordt benzeen vaak afgebeeld met een cirkel binnen een zeshoekige opstelling van koolstofatomen.
Zoals gebruikelijk in de organische chemie, zijn de koolstofatomen in bovenstaand diagram ongelabeld gelaten. In het besef dat elke koolstof 2p elektronen heeft, doneert elke koolstof een elektron in de gedelokaliseerde ring boven en onder de benzeenring. Het is de overlapping van p-orbitalen zowel boven als onder de ring die de pi wolken veroorzaakt.
In 1986 betwistten enkele chemici de gedelokaliseerde visie op benzeen in een artikel dat werd gepubliceerd in het tijdschrift Nature. Zij toonden aan dat de elektronen in benzeen vrijwel zeker gelokaliseerd zijn op bepaalde koolstofatomen. Zij toonden aan dat de aromatische eigenschappen van benzeen het gevolg zijn van spin-koppeling en niet van elektron-delokalisatie. Andere wetenschappers schreven artikelen om dit standpunt te ondersteunen in Nature in 1987. Maar chemici stappen maar langzaam af van de visie van gedelokaliseerde elektronen.
Derivaten van benzeen komen zo vaak voor als bestanddeel van organische moleculen dat er een Unicode-symbool is in het technische blok Diversen met de code U+232C (⌬) om het met drie dubbele bindingen weer te geven, en U+23E3 (⏣) voor een gedelokaliseerde versie.
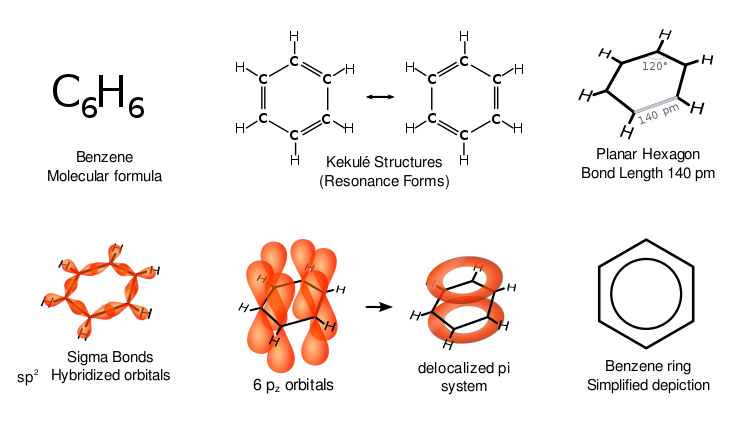
De verschillende voorstellingen van benzeen
Vragen en antwoorden
V: Wat is benzeen?
A: Benzeen is een organische chemische verbinding.
V: Wat is de chemische formule voor benzeen?
A: De chemische formule voor benzeen is C6H6.
V: Wat is het uiterlijk en de geur van benzeen?
A: Benzeen is een kleurloze en brandbare vloeistof met een zoete geur.
V: Wat is de structuur van een benzeenmolecuul?
A: Een benzeenmolecule is een ring van zes koolstofatomen die elk gebonden zijn aan één waterstofatoom. Het is een aromatische verbinding, wat betekent dat de ring afwisselend dubbele bindingen heeft.
V: Is benzeen kankerverwekkend?
A: Ja, benzeen is kankerverwekkend, wat betekent dat het kanker kan veroorzaken.
V: Wat zijn enkele reële toepassingen van benzeen?
A: Benzeen wordt gebruikt als additief in benzine, plastic, synthetisch rubber, kleurstoffen, en het is een industrieel oplosmiddel, wat betekent dat het vele andere chemische moleculen kan oplossen. Veel medicijnen bevatten ook onderdelen die van benzeen zijn gemaakt.
V: Waar komt benzeen voor?
A: Benzeen is een natuurlijk onderdeel van ruwe olie en zit dus in benzine.
Zoek in de encyclopedie