SN2-reactie
De SN2-reactie (ook bekend als bimoleculaire nucleofiele substitutie) is een substitutiereactie in de organische chemie. Het is een type nucleofiele substitutie, waarbij een lone paar van een nucleofiel een elektronengebrekkig elektrofiel centrum aanvalt en zich daaraan bindt. Hierdoor wordt een andere groep, een "vertrekkende groep", verdreven. Dus, de inkomende groep vervangt de uittredende groep in één stap. Aangezien er twee reagerende soorten betrokken zijn bij de langzame, snelheidsbepalende stap van de reactie, leidt dit tot de naam bimoleculaire nucleofiele substitutie, of SN2. In de anorganische chemie wordt de SN2-reactie vaak het uitwisselingsmechanisme genoemd.
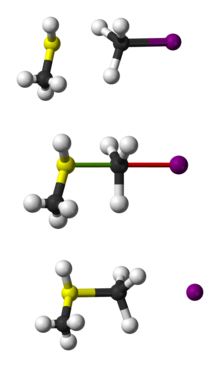
Bal-en-stok voorstelling van de SN2 reactie van CH3SH met CH3I
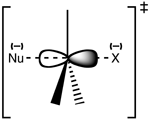
Structuur van de SN2-overgangstoestand
Reactiemechanisme
De reactie vindt meestal plaats in een alifatisch sp3-koolstofcentrum waaraan een elektronegatieve, stabiele groep is verbonden - 'X' - vaak een halogenideatoom. Het verbreken van de C-X binding en de vorming van de nieuwe C-Nu binding vinden gelijktijdig plaats om een overgangstoestand te vormen waarin de aangevallen nucleofiele koolstof pentacoordinaat is, en ongeveer sp2 gehybridiseerd. De nucleofiel valt de koolstof aan onder een hoek van 180° ten opzichte van de vertrekkende groep, omdat dit de beste overlap oplevert tussen het lone paar van de nucleofiel en de C-X σ* antibonding orbitaal. De vertrekkende groep wordt dan van de tegenoverliggende zijde geduwd en het product wordt gevormd.
Indien het substraat onder nucleofiele aanval chiraal is, kan dit, hoewel niet noodzakelijk, leiden tot een omkering van de stereochemie, de zogenaamde Walden-inversie.
In een voorbeeld van de SN2-reactie resulteert de aanval van OH- (het nucleofiel) op een broomethaan (het elektrofiel) in ethanol, waarbij bromide wordt uitgestoten als de vertrekkende groep:
Een SN2-reactie treedt op als de aanvalsroute aan de achterkant niet wordt geblokkeerd door andere atomen in het molecuul (sterisch gehinderd door substituenten op het substraat). Dit mechanisme treedt dus meestal op bij een ongehinderd primair koolstofcentrum. Als er sterische verdringing is op het substraat in de buurt van de vertrekkende groep, zoals bij een tertiair koolstofcentrum, zal de substitutie een SN1- in plaats van een SN2-mechanisme gebruiken, (een SN1 zou ook waarschijnlijker zijn met geblokkeerde moleculen omdat er dan een voldoende stabiel carbokation-tussenproduct kan worden gevormd).
In de coördinatiechemie verloopt de associatieve substitutie volgens een mechanisme dat vergelijkbaar is met dat van SN2.
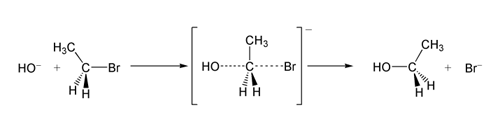
SN2 reactie van broomethaan met hydroxide ion.
Factoren die de snelheid van de reactie beïnvloeden
Vier factoren beïnvloeden de snelheid van de reactie:
- Substraat. Het substraat speelt de belangrijkste rol bij het bepalen van de snelheid van de reactie. Dit komt doordat het nucleofiel aan de achterzijde van het substraat aanvalt, waardoor de binding van de koolstof-verliezende groep wordt verbroken en de binding van koolstof-nucleofiel wordt gevormd. Om de SN2-reactiesnelheid te maximaliseren, moet de achterkant van het substraat dus zo ongehinderd mogelijk zijn. In het algemeen betekent dit dat methyl- en primaire substraten het snelst reageren, gevolgd door secundaire substraten. Tertiaire substraten nemen niet deel aan SN2-reacties, vanwege sterische hinder.
- Nucleofiel. Net als het substraat heeft sterische hinder invloed op de sterkte van het nucleofiel. Het methoxide-anion, bijvoorbeeld, is zowel een sterke base als een sterk nucleofiel, omdat het een methylnucleofiel is, en dus zeer weinig gehinderd wordt. Tert-butoxide daarentegen is een sterke base, maar een slecht nucleofiel, omdat zijn drie methylgroepen zijn benadering van de koolstof belemmeren. De sterkte van een nucleofiel wordt ook beïnvloed door de lading en de elektronegativiteit: de nucleofiliciteit neemt toe met toenemende negatieve lading en afnemende elektronegativiteit. Bijvoorbeeld, OH- is een beter nucleofiel dan water, en I- is een beter nucleofiel dan Br- (in polaire protische oplosmiddelen). In een polair aprotisch oplosmiddel stijgt de nucleofiliciteit een kolom hoger in het periodiek systeem, aangezien er geen waterstofbinding is tussen het oplosmiddel en het nucleofiel. In dit geval weerspiegelt de nucleofiliciteit de basischiteit. I- zou daarom een zwakker nucleofiel zijn dan Br- omdat het een zwakkere base is.
- Oplosmiddel. Het oplosmiddel beïnvloedt de reactiesnelheid, omdat oplosmiddelen een nucleofiel al dan niet kunnen omgeven, waardoor de benadering van het koolstofatoom al dan niet wordt belemmerd. Polaire aprotische oplosmiddelen, zoals tetrahydrofuraan, zijn voor deze reactie betere oplosmiddelen dan polaire protische oplosmiddelen, omdat polaire protische oplosmiddelen zullen worden opgelost doordat het oplosmiddel waterstofbinding aan het nucleofiel krijgt. Hierdoor kan het de koolstof met de vertrekkende groep niet aanvallen.
- De uittredende groep. De verlatende groep beïnvloedt de reactiesnelheid. Hoe stabieler de vertrekkende groep is, hoe groter de kans dat deze de twee elektronen van zijn koolstof-verlatende groep meeneemt als het nucleofiel de koolstof aanvalt. Dus hoe zwakker de vertrekkende groep is als een geconjugeerde base, hoe beter de vertrekkende groep is. Evenzo, hoe sterker het corresponderende zuur, hoe beter de vertrekkende groep. Voorbeelden van goede vertrekkende groepen zijn de halogeniden (behalve fluoride) en tosylaten. Maar HO- en H2N- zijn geen goede vertrekkende groepen.
Reactiekinetiek
De snelheid van een SN2-reactie is van de tweede orde, aangezien de snelheidsbepalende stap afhangt van de nucleofielconcentratie, [Nu-], en van de substraatconcentratie, [RX].
r = k[RX][Nu-]
Dit is een belangrijk verschil tussen het SN1- en het SN2-mechanisme. In de SN1-reactie valt het nucleofiel aan nadat de snelheidsbeperkende stap voorbij is. Maar in een SN2-reactie forceert het nucleofiel de vertrekkende groep in de beperkende stap. Met andere woorden, de snelheid van SN1-reacties hangt alleen af van de concentratie van het substraat, terwijl de SN2-reactiesnelheid afhangt van de concentratie van zowel het substraat als het nucleofiel. In gevallen waarin beide mechanismen mogelijk zijn (bijvoorbeeld bij een secundair koolstofcentrum), hangt het mechanisme af van het oplosmiddel, de temperatuur, de concentratie van het nucleofiel of van de vertrekkende groep.
SN2-reacties worden in het algemeen bevorderd in primaire alkylhalogeniden of secundaire alkylhalogeniden met een aprotisch oplosmiddel. Zij treden in te verwaarlozen mate op in tertiaire alkylhalogeniden als gevolg van sterische hinder.
SN2 en SN1 zijn twee uitersten van een glijdende schaal van reacties. Het is mogelijk vele reacties te vinden die zowel SN2 als SN1 karakter in hun mechanismen vertonen. Zo is het mogelijk om uit een alkylhalogenide een contactionpaar te vormen waarbij de ionen niet volledig gescheiden zijn. Wanneer deze substitutie ondergaan, zal de stereochemie voor veel van de reagerende moleculen omgekeerd zijn (zoals bij SN2), maar enkele moleculen kunnen behoud van configuratie vertonen. SN2-reacties komen vaker voor dan SN1-reacties.
E2 competitie
Een veel voorkomende nevenreactie bij SN2-reacties is E2-eliminatie: het inkomende anion kan fungeren als base in plaats van als nucleofiel, waardoor een proton wordt verwijderd en het alkeen wordt gevormd. Dit effect kan worden aangetoond in de gasfase-reactie tussen een sulfonaat en een eenvoudig alkylbromide, die plaatsvindt in een massaspectrometer:

Met ethylbromide is het reactieproduct overwegend het substitutieproduct. Naarmate de sterische hinder rond het elektrofiele centrum toeneemt, zoals bij isobutylbromide, wordt substitutie niet bevorderd en is eliminatie de overheersende reactie. Andere factoren die eliminatie in de hand werken zijn de sterkte van de base. Met het minder basische benzoaat-substraat reageert isopropylbromide met 55% substitutie. In het algemeen volgen gasfase-reacties en oplossingsfase-reacties van dit type dezelfde trends, hoewel in de eerste de oplosmiddeleffecten wegvallen.
Rotonde mechanisme
Een ontwikkeling die in 2008 de aandacht trok, betreft een SN2-rotondemechanisme dat is waargenomen in een gasfase-reactie tussen chloride-ionen en methyljodide met een speciale techniek die "crossed molecular beam imaging" wordt genoemd. Wanneer de chloride-ionen voldoende snelheid hebben, is de energie van de resulterende jodide-ionen na de botsing veel lager dan verwacht, en er wordt verondersteld dat energie verloren gaat als gevolg van een volledige omwenteling van de methylgroep rond het jodiumatoom voordat de eigenlijke verplaatsing plaatsvindt.
Verwante pagina's
- Substitutiereactie
- SN1 reactie
Vragen en antwoorden
V: Wat is de SN2-reactie?
A: De SN2-reactie is een substitutiereactie in de organische chemie, waarbij een nucleofiel een elektrondeficiënt elektrofiel centrum aanvalt, een vertrekkende groep verdrijft en deze vervolgens in één stap vervangt.
V: Wat voor soort substitutiereactie is de SN2-reactie?
A: De SN2-reactie is een soort nucleofiele substitutiereactie.
V: Hoeveel reagerende stoffen zijn betrokken bij de langzame, snelheidsbepalende stap van de SN2-reactie?
A: Er zijn twee reagerende soorten betrokken bij de langzame, snelheidsbepalende stap van de SN2-reactie.
V: Wat is de betekenis van de naam "bimoleculaire nucleofiele substitutie" voor de SN2-reactie?
A: De naam "bimoleculaire nucleofiele substitutie" voor de SN2-reactie verwijst naar het feit dat er twee reagerende soorten betrokken zijn bij de langzame, snelheidsbepalende stap van de reactie.
V: Wat is een nucleofiel in de context van de SN2-reactie?
A: Een nucleofiel is een molecuul of ion dat een eenzaam elektronenpaar afstaat om een chemische binding te vormen.
V: Wat is een elektrofiel in de context van de SN2-reactie?
A: Een elektrofiel is een molecuul of ion dat een elektronenpaar aanneemt om een chemische binding te vormen.
V: Hoe wordt de SN2-reactie vaak genoemd door anorganische chemici?
A: Onder anorganische chemici staat de SN2-reactie vaak bekend als het uitwisselingsmechanisme.
Zoek in de encyclopedie