Periodiek systeem
Het periodiek systeem van de chemische elementen is een lijst van bekende chemische elementen. In de tabel zijn de elementen geplaatst in de volgorde van hun atoomnummer, beginnend met het laagste nummer van één, waterstof. Het atoomnummer van een element is hetzelfde als het aantal protonen in die specifieke atoomkern. In het periodiek systeem zijn de elementen gerangschikt in perioden en groepen. Een rij elementen over de tabel heen wordt een periode genoemd. Elke periode heeft een getal; van 1 tot 8. Periode 1 heeft slechts 2 elementen: waterstof en helium. Periode 2 en periode 3 hebben allebei 8 elementen. Andere perioden zijn langer. Elementen in een periode hebben opeenvolgende atoomnummers.
Een kolom met elementen in de tabel wordt een groep genoemd. Er zijn 18 groepen in het standaard periodiek systeem. Elke groep heeft een nummer: van 1 tot 18. Elementen in een groep hebben elektronen die op vergelijkbare wijze gerangschikt zijn, afhankelijk van het aantal valentie-elektronen, waardoor ze vergelijkbare chemische eigenschappen hebben (ze gedragen zich op vergelijkbare wijze). Groep 18 staat bijvoorbeeld bekend als de edelgassen, omdat het allemaal gassen zijn en ze niet combineren met andere atomen.
Er zijn twee systemen van groepsnummers; een met Arabische cijfers (1,2,3) en de andere met Romeinse cijfers (I, II, III). De Romeinse cijfers werden in het grootste deel van de 20e eeuw gebruikt. In 1990 besloot de International Union of Pure and Applied Chemistry (IUPAC) het nieuwe systeem te gebruiken met Arabische cijfers, ter vervanging van de twee oude groepssystemen die Romeinse cijfers gebruikten.
Het periodiek systeem is door chemici gebruikt om patronen en relaties tussen elementen te observeren. Er zijn 3 hoofdgroepen in het periodiek systeem; metalen, metalloïden en niet-metalen. Zo zijn bijvoorbeeld elementen onder en ver links van de tabel het meest metaalachtig, en elementen rechtsboven het minst metaalachtig. (b.v. cesium is veel meer metaalachtig dan helium). Er zijn ook veel andere patronen en relaties.
Het periodiek systeem is uitgevonden door de Russische chemicus Dmitri IvanovitsjMendeleyev (1834-1907). Ter zijner ere werd element 101 naar hem vernoemd, mendeljevium.
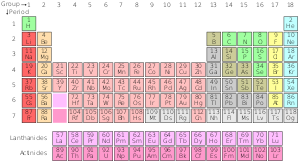
De standaardvariant van het periodiek systeem
Standaard periodiek systeem
| Groep→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 12 | 14 | 15 | 16 | 17 | |||||
| 1 | 2 | |||||||||||||||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||||||||||||
| 3 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||
| 4 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | ||
| 5 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | ||
| 6 | 55 | 56 | * Lanthaniden | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 | 81 | 82 | 83 | 84 | 85 | 86 | ||
| 7 | 87 Fr | 88 | ** Actinides | 104 | 105 | 106 | 107 | 108 | 109 | 110 | 111 | 112 | 113 | 114 | 115 | 116 | 117 | 118 | ||
| 8 | 119 Uue | 120 Ubn | *** Superactiniden | |||||||||||||||||
| * Lanthanide-Serie | 57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 | |||||
| ** Actinideserie | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 | |||||
| *** Superactinide Serie | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129Ube | 130Utn | 131Utu | 132Utb | 133Utt | 134Utq | 135Utp | |||||
| *** Superactinide Serie | 136Uth | 137Uts | 138Uto | 139Ute | 140Uqn | 141Uqu | 142Uqb | 143Uqt | 144Uqq | 145Uqp | 146Uqh | 147 eenheden | 148Uqo | 149Uqe | 150Upn | |||||
| *** Superactinide Serie | 151Upu | 152Upb | 153Upt | 154Upq | 155Upp | 156Uph | 157Ups | 158Upo | 159Upe | 160Uhn | 161Uhu | 162Uhb | 163Uht | 164Uhq | 165 pk | |||||
| *** Superactinide Serie | 166Uhh | 167Uhs | 168Uho | 169Uhe | 170Usn | 171Usu | 172Usb | 173Ust | 174Usq | 175Usp | 176Ush | 177Uss | 178Uso | 179Gebruik | 180Uon | |||||
| *** Superactinide Serie | 181Uou | 182Uob | 183Uot | 184Uoq | 185Uop | 186Uoh | 187Uos | 188Uoo | 189Uoe | 190Uen | 191Ueu | 192Ueb | 193Uet | 194Ueq | 195Uep | |||||
| *** Superactinide Serie | 196Ueh | 197Ues | 198Ueo | 199Uee | 200Bnn | 201Bnu | 202Bnb | 203Bnt | 204Bnq | 205Bnp | 206Bnh | 207Bns | 208Bno | 209Bne | 210Bun | |||||
| *** Superactinide Serie | 211Buu | 212Bub | 213 Maar | 214Buq | 215Bup | 216Buh | 217Bus | 218Buo | 219Bue | 220Bbn | 221Bbu | 222Bbb | 223Bbt | 224Bbq | 225Bbp | |||||
Chemische reeksen van het periodiek systeem
- Alkalimetalen
- Alkalische aarde
- Lanthaniden
- Actinides
- Superactiniden
- Overgangsmetalen
- Slechte metalen
- Niet-metalen
- Halogenen
Vermeld bij standaardtemperatuur en -druk. De kleur van het getal (atoomnummer) boven het element-symbool geeft de toestand van het element bij normale omstandigheden weer.
- die in het blauw zijn gassen
- die in het groen zijn vloeistoffen
- die in het zwart zijn vast
- Die met vaste randen hebben stabiele isotopen (Primordiale elementen)
- Degenen met gestreepte grenzen hebben alleen radioactieve, natuurlijk voorkomende isotopen.
- Die met stippellijsten komen van nature niet voor (Synthetische Elementen)
- die zonder grenzen te radioactief zijn om nog ontdekt te worden.
Andere methoden voor de weergave van de chemische elementen
De hierboven getoonde versie van het periodiek systeem is de meest gebruikte. Andere wijdverbreide versies zijn hieronder weergegeven:
· 
Theodor Benfey rangschikte de elementen in een spiraal, rond waterstof. Het atoomgewicht bepaalt de positie van het element.
· 
Dmitry Ivanovitsj Mendeleyev gebruikte een bloemstuk; Actiniden, Lanthaniden worden als lussen naast de hoofdgroep getoond.
· 
Timothy Stove rangschikte de elementen op kwantumnummer.
· ![]()
Betterman heeft de elementen gerangschikt op basis van hun isoëlektrische eigenschappen, die kunnen worden omgezet in een polynomiale vorm.
· 
Driehoekige versie, door Zmaczynski en Bayley
· 
In een piramide geplaatst.
Minder gebruikte versies
- De standaardtabel biedt de basis. Het is hierboven weergegeven
- Een verticale tabel voor een betere leesbaarheid in webbrowsers
- De grote tabel biedt de basis plus volledige elementnamen
- De enorme tabel biedt de basis plus volledige elementnamen en atoommassa's.
- Elektronenconfiguraties
- Metalen en niet-metalen
- Lijst van elementen: omvat naam, symbool, atoomnummer, atoommassa, groep en periode; sorteerbaar op een van deze elementen.
- Lijst van elementen per symbool
- Lijst van elementen per kookpunt
- Lijst van elementen op basis van het smeltpunt
- Lijst van elementen naar dichtheid
Gerelateerde pagina's
- Periodieke tabel groep
- Periodieke tabelperiode
- Uitgebreid periodiek systeem
Vragen en antwoorden
V: Wat is het periodiek systeem?
A: Het periodiek systeem is een tabel die alle bekende chemische elementen rangschikt in volgorde van hun atoomnummer, te beginnen met waterstof op nummer één. Elementen met vergelijkbare kenmerken worden vaak dicht bij elkaar geplaatst.
V: Hoeveel perioden en groepen zijn er in het standaard periodiek systeem?
A: Er zijn 8 perioden en 18 groepen in het standaard periodiek systeem.
V: Wat hebben elementen in een periode gemeen?
A: Elementen in een periode hebben opeenvolgende atoomnummers.
V: Wat hebben elementen in een groep gemeen?
A: Elementen in een groep hebben elektronen op dezelfde manier gerangschikt, volgens het aantal valentie-elektronen, waardoor ze vergelijkbare chemische eigenschappen hebben.
V: Wie heeft het periodiek systeem uitgevonden?
A: De Russische scheikundige Dmitry Ivanovich Mendeleyev vond het periodiek systeem uit (1834-1907).
V: Wat zijn de drie hoofdgroepen van het periodiek systeem?
A: De drie hoofdgroepen van het periodiek systeem zijn metalen, metalloïden en niet-metalen.
V: Hoe kunnen patronen en relaties tussen elementen worden waargenomen met behulp van het Periodiek Systeem?
A: Patronen en relaties tussen elementen kunnen worden waargenomen door te kijken waar ze voorkomen op het periodiek systeem; bijvoorbeeld, elementen linksonder hebben de neiging meer metaalachtig te zijn dan die rechtsboven.
Zoek in de encyclopedie