Atoomtheorie
In de scheikunde en de natuurkunde verklaart de atoomtheorie hoe ons begrip van het atoom in de loop der tijden is veranderd. Atomen werden vroeger beschouwd als de kleinste deeltjes van materie. Nu weet men echter dat atomen zijn opgebouwd uit protonen, neutronen en elektronen. Deze subatomaire deeltjes zijn opgebouwd uit quarks. Het eerste idee van het atoom kwam van de Griekse filosoof Democritus. Veel van de ideeën in de moderne theorie zijn afkomstig van John Dalton, een Brits scheikundige en natuurkundige.
De theorie is van toepassing op vaste stoffen, vloeistoffen en gassen, maar niet op een wijze die analoog is aan plasma's of neutronensterren.

Democritus was een Grieks filosoof, 460 voor Christus

Roger Joseph Boscovich. Een Kroatische Jezuïet die een prototype van de atoomtheorie

John Dalton (1766-1844), Engels scheikundige en natuurkundige
Sir Joseph John Thomson (1856-1940), Engels natuurkundige, ontdekte het elektron en zijn negatieve lading. Hij kreeg de Nobelprijs voor natuurkunde
Democritus' atoomtheorie
Democritus dacht dat als je iets steeds maar weer doormidden sneed, je uiteindelijk zou moeten ophouden. Hij zei dat dit laatste stukje materie niet meer kleiner kon worden gesneden. Democritus noemde deze kleine stukjes materie atomen, wat "ondeelbaar" betekent. Hij dacht dat atomen eeuwig zouden blijven bestaan, nooit zouden veranderen en niet vernietigd konden worden. Democritus dacht dat er niets tussen de atomen was en dat alles om ons heen verklaard kon worden als we konden begrijpen hoe atomen werkten.
Sommige andere filosofen waren het met hem eens, en anderen waren het er niet mee eens. Zij hadden geen manier om te experimenteren om aan te tonen of zijn theorie waar was of niet.
Boscovich's atoomtheorie
In 1758 beschreef Roger Joseph Boscovich een voorloper van de atoomtheorie.
Dalton's atoomtheorie
In 1803 herwerkte de Engelse wetenschapper John Dalton, geboren in Cumberland, de theorie van Democritus als volgt:
- Alle materie bestaat uit atomen.
- Dat atomen ondeelbare en onzichtbare deeltjes zijn.
- Dat atomen van hetzelfde element van dezelfde soort en massa zijn.
- De atomen die chemische verbindingen maken, zijn in vaste verhoudingen aanwezig.
- Chemische veranderingen komen overeen met een reorganisatie van de atomen die deelnemen aan de chemische reactie.
Dalton definieerde het atoom als de basiseenheid van een element dat kan deelnemen aan een chemische combinatie.
Thomson's atomische model
In 1850 construeerde Sir William Crookes een "ontladingsbuis", dat is een glazen buis zonder lucht en met metalen elektroden aan de uiteinden, aangesloten op een hoogspanningsbron. Wanneer in de buis een vacuüm wordt gecreëerd, kan een lichtontlading worden waargenomen die van de kathode (negatief geladen elektrode) naar de anode (positief geladen elektrode) gaat. Crookes noemde de emissie "kathodestralen".
Na de kathodestraal-experimenten stelde Sir Joseph John Thomson vast dat de uitgezonden straal werd gevormd door negatieve ladingen, omdat deze werden aangetrokken door de positieve pool. Thomson wist dat de atomen elektrisch neutraal waren, maar hij stelde vast dat, om dit te bereiken, een atoom dezelfde hoeveelheid negatieve en positieve ladingen moest hebben. De negatieve ladingen werden elektronen (e-) genoemd.
Volgens de vastgestelde veronderstellingen over de neutrale lading van de atomen, stelde Thomson het eerste atoommodel voor, dat werd beschreven als een positief geladen bol waarin de elektronen waren ingelegd (met negatieve lading). Het staat bekend als het plumpuddingmodel.
In 1906 stelde Robert Millikan vast dat de elektronen een Coulomb (C)-lading hadden van -1,6 * 10-19, iets wat de berekening van zijn massa mogelijk maakte als miniem, gelijk aan 9,109 * 10-31 kg.
In dezelfde tijd kon Eugene Goldstein door experimenten in 1886 met kathodeontladingsbuizen vaststellen dat de positieve ladingen een massa hadden van 1,6726 * 10-27 kg en een elektrische lading van +1,6 * 10 -19 C. Lord Ernest Rutherford noemde deze positief geladen deeltjes later protonen

Schematische voorstelling van het Thomson-model.
Rutherford's atoommodel
In 1910 kwam de Nieuw-Zeelandse natuurkundige Ernest Rutherford met het idee dat de positieve ladingen van het atoom zich vooral in het centrum, in de kern, bevinden en de elektronen (e-) daaromheen.
Rutherford toonde dit aan toen hij een bron van alfastraling (van helium) gebruikte om de zeer dunne goudvelletjes te raken, omgeven door een lampekap van zinksulfide die zichtbaar licht produceerde wanneer zij door alfastraling werden geraakt. Dit experiment werd het Geiger-Marsden-experiment of het goudfolie-experiment genoemd.
In dit stadium waren de hoofdelementen van het atoom duidelijk, plus de ontdekking dat atomen van een element in isotopen kunnen voorkomen. Isotopen verschillen in het aantal neutronen dat in de kern aanwezig is. Hoewel dit model goed werd begrepen, heeft de moderne fysica zich verder ontwikkeld en kunnen de huidige ideeën niet gemakkelijk begrijpelijk worden gemaakt. Een idee van de huidige atoomfysica kan worden gevonden in de links in de onderstaande tabel.
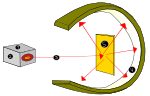
Atoomexperiment van Lord Ernest Rutherford
Moderne natuurkunde
Atomen zijn geen elementaire deeltjes, omdat zij zijn opgebouwd uit subatomaire deeltjes zoals protonen en neutronen. Protonen en neutronen zijn ook geen elementaire deeltjes, omdat zij zijn opgebouwd uit nog kleinere deeltjes, quarks genaamd, die met elkaar verbonden zijn door andere deeltjes, gluonen genaamd (omdat zij de quarks in het atoom "aan elkaar lijmen"). Quarks zijn elementair omdat quarks niet verder kunnen worden afgebroken.
Vragen en antwoorden
V: Wat is de atoomtheorie?
A: De atoomtheorie verklaart hoe ons begrip van het atoom in de loop der tijd is veranderd.
V: Wat dacht men vroeger dat atomen waren?
A: Vroeger dacht men dat atomen de kleinste stukjes materie waren.
V: Waaruit bestaan atomen eigenlijk?
A: Atomen bestaan uit protonen, neutronen en elektronen.
V: Waaruit bestaan subatomaire deeltjes?
A: Subatomaire deeltjes bestaan uit quarks.
V: Wie is de Griekse filosoof die als eerste met het idee van het atoom kwam?
A: Het eerste idee van het atoom kwam van de Griekse filosoof Democritus.
V: Wie is de Britse scheikundige en natuurkundige die veel ideeën bijdroeg aan de moderne theorie?
A: John Dalton, een Britse schei- en natuurkundige, heeft veel ideeën bijgedragen aan de moderne theorie.
V: Is de atoomtheorie van toepassing op plasma's of neutronensterren?
A: De theorie geldt voor vaste stoffen, vloeistoffen en gassen, maar niet voor plasma's of neutronensterren.
Zoek in de encyclopedie