Zuurstof (element) | chemisch element
Zuurstof is een chemisch element. Het heeft het symbool O en atoomnummer 8. Het is het derde meest voorkomende element in het heelal, na waterstof en helium.
Meer dan een vijfde van het volume van de aardatmosfeer bestaat uit zuurstof. In de lucht voegen twee zuurstofatomen zich gewoonlijk samen tot dioxygen (O
2), een kleurloos gas. Dit gas wordt vaak gewoon zuurstof genoemd. Het heeft geen smaak of geur. Het is lichtblauw als het vloeibaar of vast is.
Zuurstof maakt deel uit van de chalcogengroep van het periodiek systeem. Het is een zeer reactief niet-metaal. Het vormt oxiden en andere verbindingen met vele elementen. De zuurstof in deze oxiden en in andere verbindingen (vooral silicaatmineralen en calciumcarbonaat in kalksteen) maakt bijna de helft van de aardkorst uit, in massa.
De meeste levende wezens gebruiken zuurstof bij de ademhaling. Veel moleculen in levende wezens bevatten zuurstof, zoals eiwitten, nucleïnezuren, koolhydraten en vetten. Zuurstof is een onderdeel van water, dat al het bekende leven nodig heeft om te leven. Algen, cyanobacteriën en planten maken het zuurstofgas op aarde door fotosynthese. Zij gebruiken het licht van de zon om waterstof uit water te halen, waarbij zuurstof vrijkomt.
Boven in de atmosfeer van de aarde bevindt zich ozon (O
3), in de ozonlaag. Deze absorbeert ultraviolette straling, waardoor minder straling de grond bereikt.
Zuurstofgas wordt gebruikt voor het maken van staal, plastic en textiel. Het heeft ook medische toepassingen en wordt gebruikt voor ademhaling wanneer er geen goede lucht is (bijvoorbeeld door duikers en brandweerlieden), en voor lassen. Vloeibare zuurstof en zuurstofrijke verbindingen kunnen worden gebruikt als stuwstof voor raketten.
Geschiedenis
Zuurstofgas (O
2) werd vóór 1604 geïsoleerd door Michael Sendivogius. Vaak wordt gedacht dat het gas in 1773 werd ontdekt door Carl Wilhelm Scheele, in Zweden, of in 1774 door Joseph Priestley, in Engeland. Priestley wordt meestal beschouwd als de belangrijkste ontdekker, omdat zijn werk als eerste werd gepubliceerd (hoewel hij het "gedeflogiseerde lucht" noemde, en niet dacht dat het een chemisch element was). Antoine Lavoisier gaf in 1777 de naam oxygène aan het gas. Hij was de eerste die zei dat het een chemisch element was. Hij had ook gelijk over hoe het helpt bij de verbranding.
Vroege experimenten
Een van de eerste bekende experimenten over hoe verbranding lucht nodig heeft, werd uitgevoerd door de Griek Philo van Byzantium in de 2e eeuw voor Christus. Hij schreef in zijn werk Pneumatica dat het omkeren van een vat boven een brandende kaars en het plaatsen van water rond dit vat betekende dat er wat water in het vat kwam. Philo dacht dat dit kwam doordat de lucht werd omgezet in het klassieke element vuur. Dit is onjuist. Lang daarna ontdekte Leonardo da Vinci dat er tijdens de verbranding wat lucht werd verbruikt, waardoor er water in het vat kwam.
Eind 17e eeuw ontdekte Robert Boyle dat lucht nodig is voor verbranding. De Engelse chemicus John Mayow vulde dit aan door aan te tonen dat vuur slechts een deel lucht nodig heeft. Wij noemen dit nu zuurstof (O2 ). Hij ontdekte dat een brandende kaars in een gesloten vat het water deed stijgen om een veertiende van het volume van de lucht te vervangen voordat het doofde. Hetzelfde gebeurde wanneer een levende muis in de doos werd gestopt. Hieruit leidde hij af dat zuurstof zowel voor de ademhaling als voor de verbranding wordt gebruikt.
Phlogiston theorie
Robert Hooke, Ole Borch, Michail Lomonosov en Pierre Bayen maakten allemaal zuurstof in experimenten in de 17e en 18e eeuw. Geen van hen dacht dat het een chemisch element was. Dit kwam waarschijnlijk door het idee van de phlogiston theorie. Dit was wat de meeste mensen geloofden dat verbranding en corrosie veroorzaakte.
J. J. Becher bedacht de theorie in 1667, en Georg Ernst Stahl vulde hem aan in 1731. De flogistontheorie stelde dat alle brandbare materialen uit twee delen bestonden. Het ene deel, phlogiston genaamd, werd afgegeven bij verbranding van de stof die het bevatte.
Van materialen die weinig resten achterlaten bij verbranding, zoals hout of steenkool, werd gedacht dat ze voornamelijk uit flogiston bestonden. Dingen die corroderen, zoals ijzer, zouden heel weinig bevatten. Lucht maakte geen deel uit van deze theorie.
Ontdekking
De Poolse alchemist, filosoof en arts Michael Sendivogius schreef over iets in de lucht dat hij het "voedsel van het leven" noemde, en daarmee bedoelde hij wat wij nu zuurstof noemen. Sendivogius ontdekte, tussen 1598 en 1604, dat de stof in lucht dezelfde is die hij kreeg door kaliumnitraat te verhitten. Sommige mensen geloven dat dit de ontdekking van zuurstof was, terwijl anderen het daar niet mee eens zijn. Sommigen zeggen dat zuurstof werd ontdekt door de Zweedse apotheker Carl Wilhelm Scheele. Hij kreeg zuurstof in 1771 door kwikoxide en enkele nitraten te verhitten. Scheele noemde het gas "vuurlucht", omdat het het enige bekende gas was dat verbranding mogelijk maakte (gassen werden in die tijd "lucht" genoemd). Hij publiceerde zijn ontdekking in 1777.
Op 1 augustus 1774 richtte de Britse geestelijke Joseph Priestley zonlicht op kwikoxide in een glazen buis. Uit dit experiment kreeg hij een gas dat hij "gedeflogiseerde lucht" noemde. Hij ontdekte dat kaarsen helderder brandden in het gas en dat een muis langer leefde terwijl hij het inademde. Na het inademen van het gas zei Priestley dat het aanvoelde als normale lucht, maar dat zijn longen daarna lichter en gemakkelijker aanvoelden. Zijn bevindingen werden gepubliceerd in 1775. Omdat zijn bevindingen als eerste werden gepubliceerd, wordt vaak gezegd dat hij zuurstof heeft ontdekt.
De Franse scheikundige Antoine Lavoisier zei later dat hij de stof ook had ontdekt. Priestley bezocht hem in 1774 en vertelde hem over zijn experiment. Scheele stuurde in dat jaar ook een brief aan Lavoisier waarin hij sprak over zijn ontdekking.
Het onderzoek van Lavoisier
Lavoisier deed de eerste belangrijke experimenten met betrekking tot oxidatie. Hij was de eerste die uitlegde hoe verbranding werkt. Hij gebruikte deze en andere experimenten om het ongelijk van de phlogiston-theorie aan te tonen. Hij probeerde ook te bewijzen dat de door Priestley en Scheele ontdekte stof een chemisch element was.
In een experiment stelde Lavoisier vast dat het gewicht niet toenam wanneer tin en lucht in een gesloten vat werden verwarmd. Hij stelde ook vast dat er lucht binnenstroomde wanneer de container werd geopend. Daarna stelde hij vast dat het gewicht van het tin evenveel was toegenomen als het gewicht van de binnenstromende lucht. Hij publiceerde zijn bevindingen in 1777. Hij schreef dat lucht bestond uit twee gassen. Het ene noemde hij "vitale lucht" (zuurstof), die nodig is voor verbranding en ademhaling. Het andere (stikstof) noemde hij "azote", wat in het Grieks "levenloos" betekent. (Dit is nog steeds de naam van stikstof in sommige talen, waaronder het Frans).
Lavoisier hernoemde "vitale lucht" tot "oxygène", van Griekse woorden die "zuur maken" of "producent van zuur" betekenen. Hij noemde het zo omdat hij dacht dat zuurstof in alle zuren zat, wat onjuist is. Later beseften chemici dat Lavoiser's naam voor het gas verkeerd was, maar de naam was toen al te algemeen om te veranderen.
"Zuurstof" werd de naam in de Engelse taal, ook al waren Engelse wetenschappers ertegen.
Latere geschiedenis
Volgens de atoomtheorie van John Dalton hadden alle elementen één atoom en waren atomen in verbindingen meestal alleen. Hij dacht bijvoorbeeld ten onrechte dat water (H2 O) alleen de formule HO had. In 1805 toonden Joseph Louis Gay-Lussac en Alexander von Humboldt aan dat water bestaat uit twee waterstofatomen en één zuurstofatoom. In 1811 stelde Amedeo Avogadro op basis van de wet van Avogadro correct vast waaruit water bestaat.
Tegen het einde van de 19e eeuw ontdekten wetenschappers dat lucht in een vloeistof kon worden omgezet en dat de verbindingen erin konden worden geïsoleerd door ze samen te persen en af te koelen. De Zwitserse scheikundige en natuurkundige Raoul Pictet ontdekte vloeibare zuurstof door zwaveldioxide te verdampen om kooldioxide vloeibaar te maken. Dit werd vervolgens ook verdampt om zuurstofgas af te koelen om het in een vloeistof te veranderen. Hij stuurde op 22 december 1877 een telegram naar de Franse Academie van Wetenschappen om hen van zijn ontdekking op de hoogte te brengen.

Lavoisier ontbinding lucht
Kenmerken
Eigenschappen en moleculaire structuur
Bij normale temperatuur en druk heeft zuurstof geen kleur, geur of smaak. Het is een gas met de chemische formule O
2 genoemd.
In de vorm van zuurstof (of gewoon zuurstofgas) zijn twee zuurstofatomen chemisch aan elkaar gebonden. Deze binding kan vele namen hebben, maar wordt eenvoudigweg een covalente dubbele binding genoemd. Zuurstofgas is zeer reactief en kan met veel andere elementen reageren. Oxiden ontstaan wanneer metaalelementen reageren met zuurstof, zoals ijzeroxide, dat bekend staat als roest. Er zijn veel oxideverbindingen op aarde.
Allotropen
De gangbare allotroop (soort) zuurstof op aarde heet zuurstof (O2 ). Dit is het tweede grootste deel van de atmosfeer van de aarde, na dinitrogen (N2 ). O2 heeft een bindingslengte van 121 pm en een bindingsenergie van 498 kJ/mol Vanwege zijn energie wordt O2 gebruikt door complex leven zoals dieren.
Ozon (O3 ) is zeer reactief en beschadigt de longen wanneer het wordt ingeademd. Ozon ontstaat in de bovenste atmosfeer wanneer O2 zich verbindt met zuivere zuurstof, die ontstaat wanneer O2 wordt gesplitst door ultraviolette straling. Ozon absorbeert veel straling in het UV-gedeelte van het elektromagnetische spectrum en daarom beschermt de ozonlaag in de bovenste atmosfeer de aarde tegen straling.
Boven de ozonlaag (in lage banen om de aarde) wordt atomaire zuurstof de meest voorkomende vorm.
Tetraoxygen (O4 ) werd in 2001 ontdekt. Het bestaat alleen in extreme omstandigheden wanneer veel druk wordt uitgeoefend op O2 .
Fysieke eigenschappen
Zuurstof lost gemakkelijker uit de lucht in water op dan stikstof. Bij dezelfde hoeveelheid lucht en water is er één molecuul O2 voor elke 2 moleculen N2 (een verhouding van 1:2). Dit is anders dan bij lucht, waar de verhouding tussen zuurstof en stikstof 1:4 is. O2 lost ook gemakkelijker op in zoet water dan in zeewater. Zuurstof condenseert bij 90,20 K (-182,95 °C, -297,31 °F) en bevriest bij 54,36 K (-218,79 °C, -361,82 °F). Zowel vloeibaar als vast O2 zijn doorzichtig met een lichtblauwe kleur.
Zuurstof is zeer reactief en moet uit de buurt worden gehouden van alles wat kan branden.
Isotopen
Er zijn drie stabiele isotopen van zuurstof in de natuur. Deze zijn16 O,17 O en18 O. Ongeveer 99,7% van de zuurstof is de isotoop16 O.
Voorval
Zuurstof is het derde meest voorkomende element in het heelal, na waterstof en helium. Ongeveer 0,9% van de massa van de zon bestaat uit zuurstof.
| Tien meest voorkomende elementen in het Melkwegstelsel spectroscopisch geschat | ||||
| Z | Element | Massafractie in delen per miljoen | ||
| 1 | 739,000 | 71 × massa van zuurstof (rode balk) | ||
| 2 | 240,000 | 23 × massa van zuurstof (rode balk) | ||
| 8 | Zuurstof | 10,400 |
| |
| 6 | 4,600 |
| ||
| 10 | Neon | 1,340 |
| |
Naast ijzer is zuurstof het meest voorkomende element op aarde (in massa). Het maakt bijna de helft (46% tot 49,2%) uit van de aardkorst als onderdeel van oxideverbindingen zoals siliciumdioxide en andere verbindingen zoals carbonaten. Het is ook het hoofdbestanddeel van de oceanen op aarde, met een aandeel van 88,8% in massa. Zuurstofgas is het tweede belangrijkste onderdeel van de atmosfeer en maakt 20,95% van het volume en 23,1% van het volume uit. De aarde is vreemd in vergelijking met andere planeten, omdat een groot deel van haar atmosfeer uit zuurstofgas bestaat. Mars heeft slechts 0,1% O
2 in volume; de andere planeten hebben minder dan dat.
De veel grotere hoeveelheid zuurstofgas rond de aarde wordt veroorzaakt door de zuurstofcyclus. Fotosynthese haalt waterstof uit water met behulp van energie uit zonlicht. Hierbij komt zuurstofgas vrij. Een deel van de waterstof verbindt zich met kooldioxide om koolhydraten te maken. De ademhaling haalt vervolgens zuurstofgas uit de atmosfeer of uit het water en zet dit om in koolstofdioxide en water.
Gebruikt
Medisch
O2 is een zeer belangrijk onderdeel van de ademhaling. Daarom wordt het in de geneeskunde gebruikt. Het wordt gebruikt om de hoeveelheid zuurstof in iemands bloed te verhogen, zodat er meer ademhaling kan plaatsvinden. Hierdoor kunnen zieke mensen sneller gezond worden. Zuurstoftherapie wordt gebruikt voor de behandeling van emfyseem, longontsteking, sommige hartproblemen en elke andere ziekte waardoor iemand moeilijker zuurstof kan opnemen.
Levensonderhoud
In ruimtepakken wordt lage-druk O2 gebruikt, waarbij het lichaam met het gas wordt omgeven. Er wordt zuivere zuurstof gebruikt, maar onder een veel lagere druk. Als de druk hoger zou zijn, zou het giftig zijn.
Industrieel
Bij het smelten van ijzererts tot staal wordt ongeveer 55% van de door mensen gemaakte zuurstof gebruikt. Hiervoor wordt O2 gas via een lans onder hoge druk in het erts geïnjecteerd. Dit verwijdert zwavel of koolstof uit het erts dat niet gewenst is. Ze worden afgegeven als zwaveloxide en kooldioxide. De temperatuur kan oplopen tot 1.700 °C omdat het een exotherme reactie is.
Ongeveer 25% van de door mensen gemaakte zuurstof wordt gebruikt door chemici. Ethyleen reageert met O2 om ethyleenoxide te maken. Dit wordt vervolgens omgezet in ethyleenglycol, dat wordt gebruikt om veel producten te maken, zoals antivries en polyester (die vervolgens kunnen worden omgezet in kunststoffen en stoffen).
De overige 20% van de zuurstof die door mensen wordt gemaakt, wordt gebruikt in de geneeskunde, bij het snijden en lassen van metaal, in raketbrandstof en bij waterbehandeling.

Een zuurstofconcentrator in het huis van een emfyseempatiënt
Verbindingen
De oxidatietoestand van zuurstof is -2 in bijna alle verbindingen waarin het voorkomt. In enkele verbindingen is de oxidatietoestand -1, zoals in peroxiden. Verbindingen van zuurstof met andere zuurstoftoestanden zijn zeer zeldzaam.
Oxiden en andere anorganische verbindingen
Water (H
2O) is een oxide van waterstof. Het is het meest voorkomende oxide op aarde. Al het bekende leven heeft water nodig om te leven. Water bestaat uit twee waterstofatomen die covalent gebonden zijn aan een zuurstofatoom (zuurstof heeft een hogere elektronegativiteit dan waterstof). (Er zijn ook elektrostatische krachten (Van de'r Waals krachten) tussen de waterstofatomen en de zuurstofatomen van aangrenzende moleculen. Deze pseudobindingen brengen de atomen ongeveer 15% dichter bij elkaar dan bij de meeste andere eenvoudige vloeistoffen. Dit komt omdat Water een polaire molecule is (netto asymmetrische verdeling van elektronen) door zijn gebogen vorm, waardoor het een algemene netto veldrichting heeft, voornamelijk door de 2 niet-bindende elektronenparen van oxygenen, die de bindende H's verder naar elkaar toe duwen dan de lineaire opstelling met lagere enthalpie (zie CO2 ). Deze eigenschap wordt door microgolven benut om polaire moleculen, vooral water, in trilling te brengen. En het is verantwoordelijk voor de extra energie die nodig is om H2 0 te ontkoppelen.
Vanwege de hoge elektronegativiteit van zuurstof maakt het chemische bindingen met bijna alle andere chemische elementen. Door deze bindingen ontstaan oxiden (ijzer reageert bijvoorbeeld met zuurstof tot ijzeroxide). Het oppervlak van de meeste metalen verandert in oxiden als ze in de lucht zijn. Het oppervlak van ijzer verandert in roest (ijzeroxide) wanneer het lange tijd in lucht is. Er zijn kleine hoeveelheden kooldioxide (CO
2) in de lucht, die tijdens de fotosynthese wordt omgezet in koolhydraten. Levende wezens geven het af tijdens de ademhaling.
Organische verbindingen
Veel organische verbindingen bevatten zuurstof. Enkele klassen organische verbindingen met zuurstof zijn alcoholen, ethers, ketonen, aldehyden, carbonzuren, esters en amiden. Veel organische oplosmiddelen bevatten ook zuurstof, zoals aceton, methanol en isopropanol. Zuurstof komt ook voor in bijna alle biomoleculen die door levende wezens worden gemaakt.
Bij autoxidatie reageert zuurstof ook snel met veel organische verbindingen op of onder kamertemperatuur.
Industriële productie
Elk jaar wordt honderd miljoen ton O2 uit de lucht gehaald voor industrieel gebruik. De industrie gebruikt twee belangrijke methoden om zuurstof te maken. De meest gebruikelijke methode is gefractioneerde destillatie van vloeibare lucht. N 2verdampt, terwijl O2 als vloeistof overblijft. O2 is het tweede belangrijkste industriële gas. Omdat het economischer is, wordt zuurstof meestal als vloeistof opgeslagen en vervoerd. Een kleine stalen tank van 16 liter waterinhoud met een werkdruk van 139 bar (2015 psi) bevat ongeveer 2150 liter gas en weegt leeg 28 kilogram (62 lb). 2150 liter zuurstof weegt ongeveer 3 kilogram.
De andere belangrijkste methode om zuurstof te maken is door een stroom schone, droge lucht door een paar zeoliet moleculaire zeven te leiden. De zeoliet moleculaire zeven nemen de stikstof op. Dit levert een gasstroom op die voor 90% tot 93% uit zuurstof bestaat.
Zuurstofgas kan ook worden gemaakt door elektrolyse van water in moleculaire zuurstof en waterstof.

De rechter cilinder bevat vloeibare zuurstof.
Veiligheid
Volgens de NFPA 704 is gecomprimeerd zuurstofgas niet gevaarlijk voor de gezondheid en niet brandbaar.
Toxiciteit
Bij hoge druk kan zuurstofgas (O2 ) gevaarlijk zijn voor dieren, waaronder mensen. Het kan stuiptrekkingen en andere gezondheidsproblemen veroorzaken. Zuurstofvergiftiging begint meestal op te treden bij een druk van meer dan 50 kilopascal (kPa), wat overeenkomt met ongeveer 50% zuurstof in de lucht bij standaarddruk (lucht op aarde bevat ongeveer 20% zuurstof).
Premature baby's werden vroeger in dozen geplaatst met lucht met een hoge hoeveelheid O2 . Dit werd gestopt toen sommige baby's blind werden van de zuurstof.
Het inademen van zuivere O2 in ruimtepakken veroorzaakt geen schade omdat er een lagere druk wordt gebruikt.
Verbranding en andere gevaren
Geconcentreerde hoeveelheden zuivere O2 kunnen een snelle brand veroorzaken. Wanneer geconcentreerde zuurstof en brandstoffen dicht bij elkaar worden gebracht, kan een kleine ontsteking een enorme brand veroorzaken. De bemanning van de Apollo 1 kwam allemaal om door een brand omdat de lucht van de capsule een zeer grote hoeveelheid zuurstof bevatte.
Als vloeibare zuurstof wordt gemorst op organische stoffen, zoals hout, kan het exploderen.
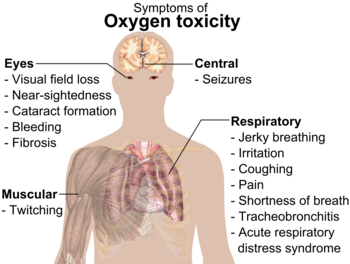
De symptomen van zuurstofvergiftiging.
Gerelateerde pagina's
Vragen en antwoorden
V: Wat is het symbool voor zuurstof?
A: Het symbool voor zuurstof is O.
V: Hoeveel zuurstofatomen zitten er meestal in dioxygen (O2)?
A: Zuurstof (O2) bevat meestal twee zuurstofatomen.
V: Welke kleur heeft vloeibare of vaste zuurstof?
A: Vloeibare of vaste zuurstof is lichtblauw van kleur.
V: Tot welke groep van het periodiek systeem behoort zuurstof?
A: Zuurstof behoort tot de chalcogenen op het periodiek systeem.
V: Hoeveel procent van het volume van de atmosfeer op aarde bestaat uit zuurstof?
A: Meer dan een vijfde van het volume van de aardatmosfeer bestaat uit zuurstof.
V: Hoe produceren planten en andere organismen de meeste zuurstof in de atmosfeer?
A: Planten en andere organismen produceren het grootste deel van de zuurstof in de atmosfeer door middel van fotosynthese, waarbij zonlicht wordt gebruikt om water om te zetten in waterstof en als bijproduct zuurstof vrijkomt.
V: Welke toepassingen heeft de vloeibare of gestolde vorm van zuurstof?
A: Vloeibare of gestolde vormen van zuurstof kunnen worden gebruikt als drijfgas voor raketten, voor lassen, voor medische doeleinden en om te ademen wanneer er geen goede lucht beschikbaar is (bijv. voor duikers en brandweerlieden).
Zoek in de encyclopedie