Koolstofdioxide
Koolstofdioxide (CO2) is een chemische verbinding. Het is een gas bij kamertemperatuur. Het bestaat uit één koolstofatoom en twee zuurstofatomen. Mensen en dieren laten kooldioxide vrijkomen als ze uitademen. Telkens als iets organisch wordt verbrand (of als er vuur wordt gemaakt), ontstaat er kooldioxide. Planten gebruiken kooldioxide om voedsel te maken. Dit proces wordt fotosynthese genoemd. De eigenschappen van kooldioxide werden in de jaren 1750 bestudeerd door de Schotse wetenschapper Joseph Black.
Koolstofdioxide is een broeikasgas. Broeikasgassen houden warmte-energie vast. Broeikasgassen veranderen het klimaat en het weer op onze planeet, de aarde. Dit wordt klimaatverandering genoemd. Broeikasgassen zijn een oorzaak van de opwarming van de aarde, de stijging van de temperatuur van het aardoppervlak.
Stuctuurformule van koolstofdioxide. C is koolstof en O is zuurstof. De dubbele lijnen geven de dubbele chemische binding tussen de atomen weer.
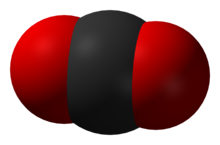
Een plaatje om eenvoudig te laten zien hoe de atomen de ruimte kunnen vullen. Het zwart is koolstof en het rood is zuurstof.
Biologische rol
Kooldioxide is een eindproduct in organismen die energie verkrijgen door suikers, vetten en aminozuren met zuurstof af te breken als onderdeel van hun metabolisme. Dit proces staat bekend als cellulaire ademhaling. Dit omvat alle planten, dieren, veel schimmels en sommige bacteriën. Bij hogere dieren gaat het kooldioxide in het bloed van de lichaamsweefsels naar de longen, waar het wordt uitgeademd. Planten nemen kooldioxide op uit de atmosfeer om te gebruiken bij de fotosynthese.
Droog ijs
Droogijs, of vast kooldioxide, is de vaste toestand van CO2-gas onder -109,3 °F (-78,5°C). Droogijs komt van nature niet op aarde voor, maar wordt door de mens gemaakt. Het is kleurloos. Mensen gebruiken droogijs om dingen koud te maken, om drankjes bruisend te maken, om grondeekhoorns te doden en om wratten te bevriezen. De damp van droogijs veroorzaakt verstikking en uiteindelijk de dood. Voorzichtigheid en professionele hulp zijn aanbevolen wanneer droogijs wordt gebruikt.
Bij de gebruikelijke druk smelt het niet van een vaste stof in een vloeistof, maar verandert het rechtstreeks van een vaste stof in een gas. Dit wordt sublimatie genoemd. Het verandert direct van een vaste stof in een gas bij elke temperatuur hoger dan extreem lage temperaturen. Droogijs sublimeert bij normale luchttemperatuur. Droogijs blootgesteld aan normale lucht geeft kooldioxide gas af dat geen kleur heeft. Kooldioxide kan vloeibaar worden bij een druk van meer dan 5,1 atmosfeer.
Kooldioxide gas dat van droogijs afkomt is zo koud dat wanneer het zich met lucht vermengt het de waterdamp in de lucht afkoelt tot mist, die eruit ziet als een dikke witte rook. Het wordt vaak in het theater gebruikt om de indruk van mist of rook te wekken.

Droog ijs in water
Isolatie en productie
Chemici kunnen kooldioxide uit koele lucht halen. Zij noemen dit luchtdistillatie. Deze methode is inefficiënt omdat een grote hoeveelheid lucht moet worden gekoeld om er een kleine hoeveelheid CO2 uit te halen. Chemici kunnen ook verschillende chemische reacties gebruiken om kooldioxide af te scheiden. Kooldioxide wordt gemaakt in de reacties tussen de meeste zuren en de meeste metaalcarbonaten. Bijvoorbeeld, de reactie tussen zoutzuur en calciumcarbonaat (kalksteen of krijt) maakt kooldioxide:
2 H C l + C a C O 3 ⟶ C a C l 2 + H 2 C O 3 {\displaystyle \mathrm {2} HCl+CaCO_{3}}longrightarrow CaCl_{2}+H_{2}CO_{3}} }
Het koolzuur (H2CO3) ontleedt dan tot water en CO2. Dergelijke reacties veroorzaken schuimvorming of borrelen, of beide. In de industrie worden dergelijke reacties vaak gebruikt om zure afvalstromen te neutraliseren.
Ongebluste kalk (CaO), een chemische stof die op grote schaal wordt gebruikt, kan worden gemaakt door kalksteen tot ongeveer 850 °C te verhitten. Bij deze reactie wordt ook CO2 gemaakt:
C a C O 3 ⟶ C a O + C O 2 {\displaystyle \mathrm {CaCO_{3} }
Kooldioxide ontstaat ook bij de verbranding van alle koolstofhoudende brandstoffen, zoals methaan (aardgas), aardoliedistillaten (benzine, diesel, kerosine, propaan), steenkool of hout. In de meeste gevallen komt er ook water vrij. De chemische reactie tussen methaan en zuurstof is bijvoorbeeld:
C H 4 + 2 O 2 ⟶ C O 2 + 2 H 2 O {\displaystyle \mathrm {CH_{4}+2 O_{2}} }
Koolstofdioxide wordt gemaakt in staalfabrieken. IJzer wordt in een hoogoven met cokes uit zijn oxiden gereduceerd, waarbij ruwijzer en kooldioxide ontstaan:
F e 2 O 3 + 3 C O ⟶ 2 F e + 3 C O 2 {\displaystyle \mathrm {Fe_{2}O_{3}+3 CO{2}} }
Gist metaboliseert suiker om koolstofdioxide en ethanol te produceren, ook bekend als alcohol, bij de productie van wijn, bier en andere sterke dranken, maar ook bij de productie van bio-ethanol:
C 6 H 12 O 6 ⟶ 2 C O 2 + 2 C 2 H 5 O H {\displaystyle \mathrm {C_{6}H_{12}O_{6}} }
Alle aërobe organismen produceren CO
2 wanneer zij koolhydraten, vetzuren en eiwitten oxideren in de mitochondriën van de cellen. Het grote aantal betrokken reacties is buitengewoon complex en niet gemakkelijk te beschrijven. (Zij omvatten celademhaling, anaërobe ademhaling en fotosynthese). Foto-autotrofen (d.w.z. planten, cyanobacteriën) gebruiken een andere reactie: Planten nemen CO
2 uit de lucht op en reageren dit, samen met water, tot koolhydraten:
n C O 2 + n H 2 O ⟶ ( C H 2 O ) n + n O 2 {\displaystyle \mathrm {nCO_{2}+nH_{2}O {longrightarrow (CH_{2}O)n+nO_{2}} }
Kooldioxide is oplosbaar in water, waarin het spontaan wordt omgezet tussen CO2 en H
2CO
3 (koolzuur). De relatieve concentraties van CO
2, H
2CO
3, en de gedeprotoneerde vormen HCO-
3(bicarbonaat) en CO2-
3(carbonaat) zijn afhankelijk van de zuurgraad (pH). In neutraal of licht alkalisch water (pH > 6,5) overheerst de bicarbonaatvorm (> 50%), die bij de pH van zeewater het meest voorkomt (> 95%), terwijl in zeer alkalisch water (pH > 10,4) de overheersende (> 50%) vorm carbonaat is. De bicarbonaat- en carbonaatvormen zijn zeer goed oplosbaar. Zo bevat luchtgeëquilibreerd oceaanwater (licht alkalisch met een typische pH = 8,2-8,5) ongeveer 120 mg bicarbonaat per liter.
Industriële productie
Industriële kooldioxide wordt voornamelijk geproduceerd bij zes processen:
- Door het opvangen van natuurlijke kooldioxidebronnen waar het ontstaat door de inwerking van aangezuurd water op kalksteen of dolomiet.
- Als bijproduct van waterstofproductie-installaties, waar methaan wordt omgezet in CO2;
- Van verbranding van fossiele brandstoffen of hout;
- Als bijproduct van de gisting van suiker bij het brouwen van bier, whisky en andere alcoholische dranken;
- Door thermische ontleding van kalksteen, CaCO
3, bij de bereiding van kalk (Calciumoxide, CaO);
Chemische reactie
Kooldioxide kan worden gemaakt met een eenvoudige chemische reactie:
C + O 2 ⟶ C O 2 {\displaystyle \mathrm {C+O_{2}}longrightarrow CO_{2}} }
Vragen en antwoorden
V: Wat is kooldioxide?
A: Koolstofdioxide is een chemische verbinding die zuur is, bestaat uit één koolstof- en twee zuurstofatomen, en is een gas bij kamertemperatuur.
V: Hoe komt kooldioxide in de atmosfeer terecht?
A: Mensen en dieren laten kooldioxide vrij wanneer zij uitademen, en telkens wanneer iets organisch wordt verbrand of een vuur wordt gemaakt.
V: Wat is fotosynthese?
A: Fotosynthese is het proces waarbij planten kooldioxide gebruiken om voedsel te maken.
V: Wie heeft de eigenschappen van kooldioxide bestudeerd?
A: De Schot Joseph Black bestudeerde de eigenschappen van kooldioxide in de jaren 1750.
V: Wat is een broeikasgas?
A: Een broeikasgas is een gas dat warmte-energie vasthoudt en het klimaat en het weer op aarde verandert.
V: Hoe draagt kooldioxide bij tot de klimaatverandering?
A: Koolstofdioxide is een broeikasgas dat bijdraagt tot de klimaatverandering doordat het warmte-energie vasthoudt en de opwarming van de aarde veroorzaakt.
V: Hoe is de concentratie van kooldioxide in de atmosfeer van de aarde geregeld?
A: De concentratie kooldioxide in de atmosfeer van de aarde wordt sinds het einde van het Precambrium geregeld door fotosynthetische organismen en geologische verschijnselen, voornamelijk vulkanen.
Zoek in de encyclopedie






