Mercurius (element) | chemisch element
Kwik, ook bekend als kwikzilver of hydrargyrum (uitgesproken als hai-DRAR-jər-əm), is een chemisch element. Het symbool in het periodiek systeem is Hg en het atoomnummer is 80. De atoommassa bedraagt 200,59.
Het symbool Hg staat voor de Latijnse Griekse naam hydrargyrum, wat waterig of vloeibaar zilver betekent.

Kwik
Geschiedenis
Niemand heeft de eer om kwik te vinden. Het was al bekend in de oudheid. Kwik werd gevonden in Egyptische graven uit 2000 voor Christus.
Ook de Chinezen wisten het al lang. In China en Tibet dacht men dat kwik hen langer zou doen leven en een betere gezondheid zou geven. Een van China's keizers, Qín Shǐ Huáng Dì, zou zijn begraven in een tombe met rivieren vol stromend kwik. Hij stierf door het drinken van een mengsel van kwik en jadepoeder omdat hij eeuwig wilde leven. Hierdoor stierf hij echter alleen aan leverfalen, vergiftiging en hersendood. De oude Grieken gebruikten kwik in zalven. De Egyptenaren en de Romeinen gebruikten het in cosmetica. Deze cosmetica deden soms pijn en maakten gezichten lelijker.
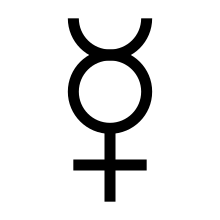
Het symbool voor de planeet Mercurius ( ☿) wordt al heel lang gebruikt om het element
Eigenschappen
Fysieke eigenschappen
Kwik is een zilverwit vloeibaar post-overgangsmetaal. De reden waarom kwik een vloeistof is, is complex. Het is zwaar; een stuk ijzer kan op kwik drijven. Vergeleken met andere metalen geleidt het slecht warmte. Het geleidt echter vrij goed elektriciteit. Kwik is het enige metaal met een bekend smeltpunt (-38,83 °C) dat lager ligt dan cesium. Kwik is een van de twee elementen die bij standaardtemperatuur en -druk vloeibaar zijn. Broom is het andere.
Kwik kan worden gezien als een overgangsmetaal, maar normaal gesproken wordt het gezien als een na-overgangsmetaal. Het staat in groep 12 van het periodiek systeem. Kwik heeft zeven stabiele (niet-radioactieve) isotopen. 202Hg is de meest voorkomende isotoop. Kwik maakt een blauwe tot ultraviolette kleur in een buis wanneer er een vonk doorheen wordt geleid. Het ultraviolette licht kan ziektekiemen doden of fluorescentielampen verlichten.
Chemische eigenschappen
Kwik is een niet-reactief metaal. Het corrodeert niet in lucht tenzij er ook waterstofsulfide aanwezig is, vergelijkbaar met zilver. Kwik kan bij verhitting in lucht oxideren tot kwik(II)oxide. Als het verder wordt verhit, ontleedt het weer in kwik en zuurstof. Het lost niet op in gewone zuren, maar wel in oxiderende zuren om kwikzouten te maken. Het kan amalgaam maken wanneer het wordt gemengd met de meeste metalen, zoals aluminium, goud en zink. IJzer, tantaal, wolfraam en platina vormen geen amalgaam met kwik. Daarom werden ijzeren kolven gebruikt om kwik te verhandelen.
Kwik kan grote hoeveelheden aluminiummetaal oplossen, waardoor het gevaarlijk is om in aluminium containers te vervoeren. De dunne oxidelaag op aluminium houdt het amalgaam (het maken van een amalgaam met) aluminium tegen, maar de oxidelaag kan worden beschadigd zodat het metaal bloot komt te liggen. Dan wordt het aluminiummetaal opgelost en oxideert het tot aluminiumoxide. Het aluminiumoxide vormt een vaste stof en laat het kwik los, dat meer aluminium amalgameert. Dit proces blijft zich herhalen totdat een grote hoeveelheid aluminium is opgelost.
Chemische verbindingen
Kwik vormt chemische verbindingen in 2 oxidatietoestanden: +1 en +2. Kwik(I)-verbindingen zijn zwakke oxidatiemiddelen en zwakke reductiemiddelen. De meeste zijn kleurloos. Ze disproportioneren gemakkelijk tot kwik(II)verbindingen en kwikmetaal. Ze reageren met zuurstof in de lucht om kwik(II)verbindingen te maken. Veel kwik(I)verbindingen lossen niet op in water. Kwik(I)chloride is een van de meest voorkomende kwik(I)verbindingen. Kwik(II)verbindingen zijn sterke oxidatiemiddelen en zeer corrosief. Kwik(II)-verbindingen zijn rood, geel of kleurloos. Kwik(II)oxide en kwik(II)chloride zijn de meest voorkomende kwik(II)verbindingen in het laboratorium.
Eén ding hebben ze gemeen: ze zijn allemaal giftig. De oplosbare zijn giftiger dan de onoplosbare.
Kwik(I)-verbindingen
Ook wel kwikhoudende verbindingen genoemd, zijn zwakke reductiemiddelen en zwakke oxidatiemiddelen. De meeste lossen niet op in water, waardoor ze minder giftig zijn dan kwik(II)-verbindingen. De meeste zijn kleurloos of geel.
- Kwik(I)bromide, ondoorzichtige witte vaste stof
- Kwik(I)chloride, calomel, onoplosbaar, wit
- Kwik(I)fluoride, lichtgeel
- Kwik(I)jodide, weinig oplosbaar, onstabiel, geel
- Kwik(I)nitraat, zeer slecht oplosbaar, wit
- Kwik(I)sulfaat, lichtgele vaste stof
Kwik(II)-verbindingen
Ook bekend als kwikverbindingen zijn sterke oxidatiemiddelen. De meeste lossen op in water, waardoor ze zeer giftig zijn. Ze zijn kleurloos of rood.
- Kwik(II)bromide, witte vaste stof
- Kwik(II)chloride, witte vaste stof, bijtend sublimaat
- Kwik(II)fluoride, witte vaste stof
- Kwik(II)jodide, enigszins oplosbaar, helderrood
- Kwik(II)oxide, oranje, geel of rood, lost niet op in water zoals de meeste oxiden
- Kwik(II)nitraat, oplosbaar, wit, gebruikt om hoeden te maken
- Kwik(II)sulfaat, witte vaste stof
- Kwik(II)sulfide, rode vaste stof
Organische kwikverbindingen
Deze bevatten kwik dat gereageerd heeft met een organische molecule. Ze zijn nog giftiger dan andere kwikverbindingen omdat ze zeer gemakkelijk worden opgenomen.
- Dimethylkwik, kleurloze, uiterst giftige vloeistof

Kwik(II)fulminaat
Voorval
Kwik is een zeldzaam metaal. Het komt ongeveer evenveel voor als zilver. Kwik is niet duur zoals zilver, omdat het kwik heel gemakkelijk te verkrijgen is van de plaatsen waar het gevonden wordt. Kwik komt in elementaire (vloeibare) vorm voor in de natuur, maar dat is niet gebruikelijk. Kwik als element is de enige vloeistof die door de International Mineralogical Association wordt erkend als mineraal. Het wordt meestal gevonden in de vorm van cinnaber, een kwik(II)sulfidemineraal. De grootste afzettingen van cinnaber werden vroeger gevonden in Spanje, maar nu in China. Het komt ook voor in andere mineralen zoals calomel, een kwik(I)chloride mineraal.

Nog een rots met vloeibaar kwik erop

Kleine klodders vloeibaar kwik als element samen met strepen cinnaber
Bereiding
China en Kirgizië zijn de twee belangrijkste producenten van kwik. Mijnen in Italië, de Verenigde Staten en Mexico zijn gesloten. China opent meer mijnen omdat de Europese Unie fluorescentielampen wil gaan gebruiken, die kwik nodig hebben.
Kwik wordt gemaakt door cinnaber te roosteren in een oven. Het sulfide wordt geoxideerd tot zwaveldioxide en er blijft kwik achter.
Toepassingen van kwik
Medisch gebruik
Kwik werd gebruikt in tandvullingen totdat het werd vervangen door veiliger materialen. Ze zijn een amalgaam van kwik met een ander element. Een organische kwikverbinding genaamd thiomersal wordt gebruikt om vaccins te conserveren. Merbromin, een andere organische kwikverbinding, wordt gebruikt als antisepticum. Het is verboden in sommige landen zoals de VS.
Kwik(I)chloride (ook bekend als calomel of kwikchloride) werd gebruikt als diureticum, huidontsmettingsmiddel en laxeermiddel. Samen met andere kwikverbindingen werd kwik(II)chloride (ook bekend als kwikchloride of bijtend sublimaat) gebruikt om syfilis te behandelen. Het probleem hierbij was dat kwik(II)chloride zeer giftig is. Soms werden de symptomen van zijn giftigheid verward met die van de syfilis die het dacht te behandelen. Het wordt ook gebruikt als ontsmettingsmiddel. Blauwe massa, een pil of siroop waarin kwik het hoofdbestanddeel is, werd in de jaren 1800 voorgeschreven voor verschillende aandoeningen zoals constipatie, depressie, kinderwens en tandpijn. In het begin van de 20e eeuw werd kwik eenmaal per jaar aan kinderen gegeven als laxeermiddel en ontwormingsmiddel. Ook in bijtpoeders voor zuigelingen werd het gebruikt.
Sinds de jaren 1930 bevatten sommige vaccins het conserveermiddel thiomersal. In het lichaam wordt dit veranderd in ethylkwik. Aanvankelijk werd gedacht dat dit conserveermiddel op basis van kwik autisme bij kinderen kan veroorzaken of uitlokken, maar wetenschappelijke studies konden een dergelijk verband niet aantonen. Daarom is thiomersal verwijderd uit de meeste Amerikaanse vaccins die worden aanbevolen voor kinderen van zes jaar en jonger. Er zijn bepaalde uitzonderingen op deze regel voor griepvaccins. In sommige gevallen kunnen vaccins nog steeds zeer kleine hoeveelheden thiomersal bevatten.
Cinnaber is nog steeds een belangrijk bestanddeel van de traditionele Chinese, Tibetaanse en Ayurvedische geneeskunde. Sommige landen staan het gebruik van kwik of kwikverbindingen in geneesmiddelen niet toe. Daarom is cinnaber onlangs vervangen door minder giftige producten.
Tegenwoordig is het gebruik van kwik in de geneeskunde in alle opzichten sterk afgenomen, vooral in de ontwikkelde landen. Thermometers en bloeddrukmeters waarin kwik wordt gebruikt, werden respectievelijk in het begin van de 18e en aan het eind van de 19e eeuw uitgevonden. Nu neemt het gebruik ervan af en is het in sommige landen, staten en medische instellingen verboden. In 2002 nam de Amerikaanse Senaat wetgeving aan om de verkoop van kwikthermometers zonder recept geleidelijk te verbieden. In 2003 werden Washington en Maine de eerste staten die kwikbloeddrukmeters verboden. Kwikverbindingen zitten in sommige vrij verkrijgbare geneesmiddelen, waaronder topische antiseptica, stimulerende laxeermiddelen, luieruitslagzalf, oogdruppels en neussprays. De FDA heeft "onvoldoende gegevens om de veiligheid en doeltreffendheid" van het kwik in deze producten algemeen te erkennen. Kwik wordt nog steeds gebruikt in sommige diuretica, hoewel voor de meeste therapeutische toepassingen andere dingen kunnen worden gebruikt.
Ander gebruik
Ook kwik wordt gebruikt:
- In cosmetica, (thiomersal wordt veel gebruikt om mascara te maken).
- Als vloeibare elektrolyt in een variant van het chlooralkaliproces.
- In de mijnbouw, vooral van goud en zilver.
- In kwikdamplampen en fluorescentielampen.
- Bepaalde thermometers, barometers en manometers. Vanwege zijn giftigheid kan het voor de meeste van deze toepassingen worden vervangen door alcohol.
- Bepaalde elektrische schakelaars die in- of uitschakelen wanneer ze worden gekanteld.
In 2017 was het wereldwijde gebruik van kwik minder dan de helft van dat in 1980.
Toxiciteit
Kwik is vloeibaar bij kamertemperatuur, en kwikdampen zijn zeer giftig. Ingenomen elementair kwik is minder gevaarlijk. De grootste problemen zijn organische kwikverbindingen die met voedsel worden gegeten. Net als andere zware metalen zijn ook anorganische verbindingen zoals kwik(II)nitraat zeer giftig door inname (eten) of inademing (inademen) van de stof. Kwik kan zowel chronische als acute vergiftiging veroorzaken.
In het jaar 1810 stierven meer dan 200 mensen aan kwikvergiftiging op het schip Triumph omdat een vat met kwik had gelekt.
Kwik is uiterst giftig en moet voorzichtig worden gebruikt. Wanneer kwik wordt gemorst, zijn er speciale manieren om het op te ruimen. Kleinere druppels moeten worden samengevoegd tot een grotere druppel op harde oppervlakken, zodat ze gemakkelijker kunnen worden verwijderd (bijvoorbeeld in een zak die kan worden weggegooid). Stofzuigers en bezems mogen niet worden gebruikt. Deze kunnen kwik namelijk nog meer verspreiden. Daarna moeten elementen zoals zwavel- of zinkpoeder over de plek worden gestrooid en vervolgens worden opgevangen en schoongemaakt. Het is niet eenvoudig om kwik helemaal van kleding te reinigen, dus is het beter om ze niet meer te gebruiken. Ook het inademen van kwikdamp is zeer gevaarlijk.
Gerelateerde pagina's
- Kwikverbindingen
- Lijst van gemeenschappelijke elementen
- Periodiek systeem
Vragen en antwoorden
V: Wat is kwik?
A: Kwik is een chemisch element met het symbool Hg en atoomnummer 80.
V: Hoe wordt het uitgesproken?
A: Het wordt uitgesproken als "hai-DRAR-jər-əm".
V: Waar staat het symbool Hg voor?
A: Het symbool Hg staat voor de gelatiniseerde Griekse naam hydrargyrum, wat waterig of vloeibaar zilver betekent.
V: Wat is de atoommassa?
A: De atoommassa is 200,59.
V: Bestaat er nog een andere naam voor kwik?
A: Ja, het staat ook bekend als kwikzilver of hydrargyrum.
V: Waar staat kwik op het periodiek systeem?
A: Het symbool op het periodiek systeem is Hg.
V: Wat betekent zijn Latijnse Griekse naam?
A: De gelatiniseerde Griekse naam hydrargyrum betekent waterig of vloeibaar zilver.
Zoek in de encyclopedie



